题目内容
11.用铁、铝混合物进行如下实验: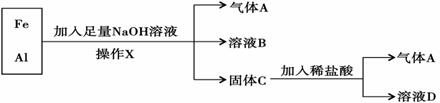
操作X的名称是过滤.若铝和铁的物质的量相等,前后两次生成气体A的物质的量之比为3:2,溶液B中阴离子除OH-外还有AlO2-.溶液D中存在的金属离子主要为Fe2+.
分析 实现固体和液体的分离采用过滤的方法;生成的气体A为氢气,根据电子守恒计算出生成氢气的物质的量之比;根据金属铝和氢氧化钠反应,但是金属铁和氢氧化钠不反应,但是可以和盐酸反应来回答.
解答 解:金属铁和金属铝的混合物中加入氢氧化钠后,会和金属铝发生反应生成偏铝酸钠和氢气,金属铁和氢氧化钠不反应,所以A是氢气,B是偏铝酸钠和过量的氢氧化钠的混合物,固体C是金属铁,金属铁可以和盐酸反应生成氯化亚铁和氢气,所以D是氯化亚铁,
实现金属铁和偏铝酸钠、氢氧化钠混合物分离的方法是过滤;
气体A是氢气,若铝和铁的物质的量相等,设都是1mol,根据电子守恒可知生成氢气的物质的量之比为:$\frac{1mol×3}{2}$:$\frac{1mol×2}{2}$=3:2;
溶液B是偏铝酸钠和过量的氢氧化钠的混合物,则溶液B中阴离子除OH-外还有AlO2-;
铁可以和盐酸反应生成氯化亚铁和氢气,D是氯化亚铁,则溶液D中存在的金属离子主要为Fe2+,
故答案为:过滤;3:2;AlO2-;Fe2+.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应的原理为解答关键,注意掌握守恒思想在化学计算中的应用,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
1.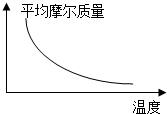 可逆反应2A+B?2C(g)(正反应放热),随温度变化气体平均摩尔质量如图所示,则下列叙述正确的是( )
可逆反应2A+B?2C(g)(正反应放热),随温度变化气体平均摩尔质量如图所示,则下列叙述正确的是( )
 可逆反应2A+B?2C(g)(正反应放热),随温度变化气体平均摩尔质量如图所示,则下列叙述正确的是( )
可逆反应2A+B?2C(g)(正反应放热),随温度变化气体平均摩尔质量如图所示,则下列叙述正确的是( )| A. | A和B可能都是固体 | B. | A和B一定都是气体 | ||
| C. | 若B为固体,则A一定是气体 | D. | A和B不可能都是气体 |
19.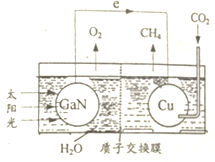 科学家用氮化镓材料与铜组装如图所示人工光合系统,利用该装置成功地实现了以CO2和H20合成CH4.下列有关说法正确的是
科学家用氮化镓材料与铜组装如图所示人工光合系统,利用该装置成功地实现了以CO2和H20合成CH4.下列有关说法正确的是
( )
 科学家用氮化镓材料与铜组装如图所示人工光合系统,利用该装置成功地实现了以CO2和H20合成CH4.下列有关说法正确的是
科学家用氮化镓材料与铜组装如图所示人工光合系统,利用该装置成功地实现了以CO2和H20合成CH4.下列有关说法正确的是( )
| A. | 该装置中存在两种能量的转换形式 | |
| B. | 电池工作时,H+向负极移动 | |
| C. | 为提高该人工光合系统的工作效率,最好向装置中加入少量盐酸 | |
| D. | 铜电极表面的电极反应式为:C02+8e-+8H+═CH4+2H20 |
6.下列说法正确的是( )
| A. | 常温下,加水稀释0.01mol•L-1的氨水,c(NH4+)•c(OH-)逐渐增大 | |
| B. | 在H2SO3溶液中滴加少量NaClO溶液,c(SO32-)逐渐增大 | |
| C. | 在H2S溶液中滴加CuSO4溶液,H2S的电离程度逐渐增大 | |
| D. | 微热醋酸溶液,$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$保持不变 |
3.下列过程属于物理变化的是( )
| A. | 平行光照射胶体产生丁达尔效应 | B. | 紫外线照射下,液态蛋白质凝固 | ||
| C. | 铁在潮湿的空气中生锈 | D. | 铝遇到冷的浓硝酸溶液发生钝化 |

 已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大.其中基态A原子价电子排布式为nsnnpn+1;化合物B2E为离子化合物,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质常用于制作太阳能电池和集成电路芯片;F原子最外层电子数与B的相同,其余各内层轨道均充满电子.请根据以上信息,回答下列问题(答题时,A、B、C、D、E、F用所对应的元素符号表示):
已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大.其中基态A原子价电子排布式为nsnnpn+1;化合物B2E为离子化合物,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质常用于制作太阳能电池和集成电路芯片;F原子最外层电子数与B的相同,其余各内层轨道均充满电子.请根据以上信息,回答下列问题(答题时,A、B、C、D、E、F用所对应的元素符号表示): 实验室用苯和浓硝酸、浓硫酸发生反应制取硝基苯的装置如图所示.回答下列问题:
实验室用苯和浓硝酸、浓硫酸发生反应制取硝基苯的装置如图所示.回答下列问题: ;反应类型:取代反应
;反应类型:取代反应 太阳能电池又称为“光电池”,是一种利用太阳光直接发电的光电半导体薄片.该半导体薄片的主要成分是( )
太阳能电池又称为“光电池”,是一种利用太阳光直接发电的光电半导体薄片.该半导体薄片的主要成分是( )