题目内容
 现在七种元素,其中A、B、C、D、E为短周期元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答下列问题.
现在七种元素,其中A、B、C、D、E为短周期元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答下列问题.| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B原子L层有2个未成对电子 |
| C元素原子的核外p电子数比s电子数少1 |
| D元素最外层电子数是电子层数的3倍 |
| E原子的第一到第四电离能分别是:I1=738kJ/mol、I2=1451kJ/mol、I3=7733kJ/mol、I4=10540kJ/mol |
| F是前四周期中电负性最小的元素 |
| G原子核外M层全充满,N层只有1个电子 |
(2)图为B元素的某种单质晶体X的晶胞,其中含有
(3)C基态原子中能量最高的电子,其原子轨道呈
(4)A和D能形成A2D和A2D2两种化合物,其中A2D分子的VSEPR模型是
(5)某同学根据上述信息,推断E基态原子的核外电子排布式为:
 该同学所画的电子排布图违背了
该同学所画的电子排布图违背了(6)检验F元素的方法是
(7)往G元素的硫酸盐溶液中逐滴加入过量C元素的氢化物的水溶液得到深蓝色的透明溶液,若加入乙醇,将析出深蓝色的晶体,该晶体的化学式是
考点:位置结构性质的相互关系应用,晶胞的计算
专题:元素周期律与元素周期表专题,化学键与晶体结构
分析:A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素,则A为氢元素,C元素原子的核外p电子数比s电子数少1,则C为氮元素,B原子L层有2个未成对电子,则B为碳元素或氧元素,由于原子序数小C,所以B为碳元素,D元素最外层电子数是电子层数的3倍,则D为氧元素,E原子的第一到第四电离能分别是:I1=738kJ/mol、I2=1451kJ/mol、I3=7733kJ/mol、I4=10540kJ/mol,则可知E最外层有2个电子,A、B、C、D、E、F、G原子序数依次增大,A、B、C、D、E为短周期元素,F、G为第四周期元素,所以E为镁元素,F是前四周期中电负性最小的元素,则F为钾元素,G原子核外M层全充满,N层只有1个电子,则M为铜元素,据此答题.
解答:
解:A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素,则A为氢元素,C元素原子的核外p电子数比s电子数少1,则C为氮元素,D元素最外层电子数是电子层数的3倍,则D为氧元素,E原子的第一到第四电离能分别是:I1=738kJ/mol、I2=1451kJ/mol、I3=7733kJ/mol、I4=10540kJ/mol,则可知E最外层有2个电子,A、B、C、D、E、F、G原子序数依次增大,A、B、C、D、E为短周期元素,F、G为第四周期元素,所以E为镁元素,F是前四周期中电负性最小的元素,则F为钾元素,G原子核外M层全充满,N层只有1个电子,则M为铜元素,
(1)CA5为NH5,NH5为离子化合物,是由NH4+与H-两种粒构成,电子式为 ,故答案为:
,故答案为: ;
;
(2)B为碳元素,根据均摊法可知,在晶胞中含有碳原子数为8×
+6×
+4=8,故答案为:8;
(3)C为N元素,核外电子排布式为1s2ns2np3,基态原子中能量最高的电子,处于2p能级,原子轨道呈纺锤形,故答案为:纺锤;
(4)A2D为H2O,A2D2为H2O2,在中氧原子的价层电子对数为
=4,所以H2O分子的VSEPR模型是四面体,H2O2中氧原子的价层电子对数为
=4,所以氧原子的杂化方式为sp3杂化,故答案为:四面体;sp3;
(5)某同学根据上述信息,推断E基态原子的核外电子排布为 ,该同学所画的电子排布图中3s能级,2个电子自旋方向相同,违背了泡利不相容原理,
,该同学所画的电子排布图中3s能级,2个电子自旋方向相同,违背了泡利不相容原理,
故答案为:泡利不相容原理;
(6)F为K,检验K元素应利用焰色反应,原因为当基态原子的电子吸收能量后,电子会跃迁到较高能级,变成激发态原子.电子从较高能量的激发态跃迁到较低能量的激发态乃至基态时,将以光的形式释放能量,
故答案为:焰色反应;当基态原子的电子吸收能量后,电子会跃迁到较高能级,变成激发态原子.电子从较高能量的激发态跃迁到较低能量的激发态乃至基态时,将以光的形式释放能量;
(7)G元素的硫酸盐为CuSO4,C元素的氢化物水溶液为氨水,向CuSO4溶液中逐滴加入过量氨水,生成的配合物的化学式为[Cu(NH3)4]SO4?H2O,故答案为:[Cu(NH3)4]SO4?H2O.
(1)CA5为NH5,NH5为离子化合物,是由NH4+与H-两种粒构成,电子式为
 ,故答案为:
,故答案为: ;
;(2)B为碳元素,根据均摊法可知,在晶胞中含有碳原子数为8×
| 1 |
| 8 |
| 1 |
| 2 |
(3)C为N元素,核外电子排布式为1s2ns2np3,基态原子中能量最高的电子,处于2p能级,原子轨道呈纺锤形,故答案为:纺锤;
(4)A2D为H2O,A2D2为H2O2,在中氧原子的价层电子对数为
| 6+2 |
| 2 |
| 6+1+1 |
| 2 |
(5)某同学根据上述信息,推断E基态原子的核外电子排布为
 ,该同学所画的电子排布图中3s能级,2个电子自旋方向相同,违背了泡利不相容原理,
,该同学所画的电子排布图中3s能级,2个电子自旋方向相同,违背了泡利不相容原理,故答案为:泡利不相容原理;
(6)F为K,检验K元素应利用焰色反应,原因为当基态原子的电子吸收能量后,电子会跃迁到较高能级,变成激发态原子.电子从较高能量的激发态跃迁到较低能量的激发态乃至基态时,将以光的形式释放能量,
故答案为:焰色反应;当基态原子的电子吸收能量后,电子会跃迁到较高能级,变成激发态原子.电子从较高能量的激发态跃迁到较低能量的激发态乃至基态时,将以光的形式释放能量;
(7)G元素的硫酸盐为CuSO4,C元素的氢化物水溶液为氨水,向CuSO4溶液中逐滴加入过量氨水,生成的配合物的化学式为[Cu(NH3)4]SO4?H2O,故答案为:[Cu(NH3)4]SO4?H2O.
点评:本题主要考查了电子式、杂化轨道、电子能级的跃迁、配合物知识,涉及知识点较多,中等难度,解题时注意元素的位、构、性之间的关系的应用.

练习册系列答案
相关题目
一定条件下,可逆反应N2+3H2?2NH3(正反应为放热反应)达到平衡,当单独改变下述条件时,有关叙述错误的是( )
| A、加催化剂,V正、V逆都发生变化,且变化的倍数相等,平衡不移动 |
| B、加压,V正、V逆都增大,且V正增大的倍数大于V逆增大的倍数,平衡正移 |
| C、降温,V正、V逆都减小,且V逆减小的倍数小于V正减小的倍数,平衡逆移 |
| D、减少氨气的浓度,V正不变,V逆减小,且平衡向正反应方向移动 |
某废水含有下列离子中的5种(忽略水的电离及离子的水解),K+、Cu2+、Al3+、Fe2+、Cl-、CO32-、NO3-、SO42-,测得各种离子的物质的量浓度相等.为探究废水的组成,某同学进行了如下实验:
①用铂丝蘸取少量溶液,在火焰上灼烧,透过蓝色钴玻璃观察无紫色火焰.
②另取溶液加入足量稀盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变.
③另取溶液加入BaCl2溶液,有白色沉淀生成.
根据上述实验,以下推测正确的是( )
①用铂丝蘸取少量溶液,在火焰上灼烧,透过蓝色钴玻璃观察无紫色火焰.
②另取溶液加入足量稀盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变.
③另取溶液加入BaCl2溶液,有白色沉淀生成.
根据上述实验,以下推测正确的是( )
| A、溶液中无法确定Al3+的存在与否 |
| B、原溶液中不含的离子为:K+、Al3+、CO32- |
| C、步骤②中可以确定Fe2+、NO3-的存在 |
| D、步骤③中共有2种钡盐沉淀 |
根据气体的性质,推测利用如图装置,下列气体可制得的是( )


| A、NO2 |
| B、Cl2 |
| C、O2 |
| D、NH3 |
肼(N2H4)是火箭发动机的一种燃料,反应时N2O4为氧化剂,反应生成N2和水蒸气.
已知:N2(g)+2O2(g)=N2O4(g);△H=+8.7kJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O(g);△H=-534kJ/mol
下列表示肼和N2O4反应的热化学方程式,正确的是( )
已知:N2(g)+2O2(g)=N2O4(g);△H=+8.7kJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O(g);△H=-534kJ/mol
下列表示肼和N2O4反应的热化学方程式,正确的是( )
| A、2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g);△H=-1076.7 kJ/mol | ||||
B、N2H4(g)+
| ||||
| C、2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g);△H=-542.7 kJ/mol | ||||
| D、2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g);△H=-1059.3 kJ/mol |
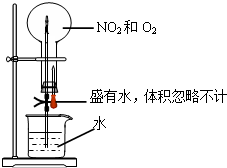 用如图所示的装置做喷泉实验,该实验条件下的气体摩尔体积为a L/mol,且不考虑2NO2?N2O4.最终液体充满了烧瓶,则烧瓶内溶液的物质的量浓度约是( )
用如图所示的装置做喷泉实验,该实验条件下的气体摩尔体积为a L/mol,且不考虑2NO2?N2O4.最终液体充满了烧瓶,则烧瓶内溶液的物质的量浓度约是( )A、
| ||
B、
| ||
C、
| ||
| D、无法计算 |
