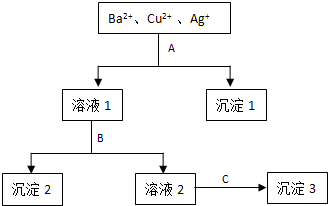
题目内容
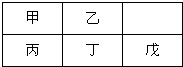 短周期金属元素甲-戊在元素周期表中的相对位置如图,下列判断正确的是( )
短周期金属元素甲-戊在元素周期表中的相对位置如图,下列判断正确的是( )| A、原子半径:丙<丁<戊 |
| B、戊只与强碱反应 |
| C、最高价氧化物对应水化物碱性:乙>丁>戊 |
| D、金属性:丙>甲 |
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:根据短周期金属元素甲-戊在元素周期表中的相对位置,可知甲为Li、丙为Na、乙为Be、丁为Mg、戊为Al,
A.同周期原子半径从左向右在减小;
B.戊为Al,可以与强酸、强碱反应;
C.同周期从左向右金属性减弱,同主族从上向下,金属性增强,金属性越强,对应的最高价氧化物的水化物的碱性越强;
D.同主族从上到下元素的金属性在增强,
据此判断;
A.同周期原子半径从左向右在减小;
B.戊为Al,可以与强酸、强碱反应;
C.同周期从左向右金属性减弱,同主族从上向下,金属性增强,金属性越强,对应的最高价氧化物的水化物的碱性越强;
D.同主族从上到下元素的金属性在增强,
据此判断;
解答:
解:根据短周期金属元素甲-戊在元素周期表中的相对位置,可知甲为Li、丙为Na、乙为Be、丁为Mg、戊为Al,
A.同周期原子半径从左向右在减小,则原子半径为丙>丁>戊,故A错误;
B.戊为Al,可以与强酸、强碱反应,故B错误;
C.同周期从左向右金属性减弱,同主族从上向下,金属性增强,金属性越强,对应的最高价氧化物的水化物的碱性越强,则在乙、丁、戊的氢氧化物中碱性最强的为丁,故C错误;
D.同主族从上到下元素的金属性在增强,则金属性为甲<丙,故D正确;
故选D.
A.同周期原子半径从左向右在减小,则原子半径为丙>丁>戊,故A错误;
B.戊为Al,可以与强酸、强碱反应,故B错误;
C.同周期从左向右金属性减弱,同主族从上向下,金属性增强,金属性越强,对应的最高价氧化物的水化物的碱性越强,则在乙、丁、戊的氢氧化物中碱性最强的为丁,故C错误;
D.同主族从上到下元素的金属性在增强,则金属性为甲<丙,故D正确;
故选D.
点评:本题考查元素周期律和元素周期表,熟悉同主族、同周期元素性质的变化规律即可解答,题目难度不大.

练习册系列答案
相关题目
下列各个反应,可以应用于工业生产的是( )
| A、钠在氯气中燃烧,生产食盐 |
| B、二氧化锰和浓盐酸共热,制取氯气 |
| C、氯气与消石灰反应,生产漂白粉 |
| D、氢气和氯气混合见光爆炸制氯化氢,再生产盐酸 |
已知石墨的燃烧热为△H1,金刚石的燃烧热为△H2,下列说法正确的是( )
| A、由于燃烧均为放热反应,所以石墨为重要的能源 |
| B、由于燃烧反应放热,所以△H1和△H2均取正值 |
| C、由于石墨和金刚石同为碳元素组成,所以△H1=△H2 |
| D、由于石墨和金刚石属于不同的单质,所以△H1和△H2不等 |
在一密闭容器中有如下反应:aX(g)+bY(s)?nW(g)△H=QkJ/mol.某化学兴趣小组的同学根据此反应在不同条件下的实验数据,作出了曲线图:其中,ω(W)表示W在反应混合物中的百分含量,t表示反应时间.其它条件不变时,下列分析正确的是( )
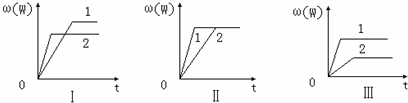

| A、图Ⅰ可能是不同压强对反应的影响,且P2>P1,a>n |
| B、图Ⅱ可能是在同温同压下催化剂对反应的影响,且2使用的催化剂效果好 |
| C、图Ⅱ可能是不同压强对反应的影响,且P1>P2,n=a+b |
| D、图Ⅲ可能是不同温度对反应的影响,且T1>T2,Q>0 |
下列不需要用到二氧化硅的是( )
| A、光导纤维 | B、计算机芯片 |
| C、石英钟表 | D、普通玻璃 |
检查烧碱中是否混有纯碱的正确方法是( )
| A、加热看是否有气体生成 |
| B、滴入盐酸后看是否有气体生成 |
| C、溶解后检查溶液的酸碱性 |
| D、灼烧看火焰是否为黄色 |