题目内容
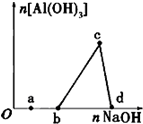 一定量的酸性AlCl3 溶液中逐滴加入NaOH溶液,生成沉淀Al(OH)3的量随NaOH加入量的变化关系如图所示.则下列离子组在对应的溶液中一定能大量共存的是( )
一定量的酸性AlCl3 溶液中逐滴加入NaOH溶液,生成沉淀Al(OH)3的量随NaOH加入量的变化关系如图所示.则下列离子组在对应的溶液中一定能大量共存的是( )| A、a点对应的溶液中:K+、Ag+、Ca2+、NO3- |
| B、b点对应的溶液中:K+、NH4+、CO32-、SO42- |
| C、c点对应的溶液中:Na+、Fe3+、SO42-、HCO3- |
| D、d点对应的溶液中:Na+、S2-、SO42-、Cl- |
考点:镁、铝的重要化合物,离子反应发生的条件
专题:
分析:首先发生NaOH+HCl═NaCl+H2O,盐酸反应完毕,再发生反应3NaOH+AlCl3=3NaCl+Al(OH)3↓,最后发生NaOH+Al(OH)3=NaAlO2+2H2O,沉淀溶解,a点溶液中有氢离子、氯离子、铝离子、钠离子;b点溶液中有氯离子、铝离子、钠离子;c点溶液中有氯离子、钠离子;d点溶液中有氯离子、偏铝离子、钠离子,据此进行分析.
解答:
解:A.溶液中有氯离子,和Ag+不共存,故A错误;
B.b点溶液中有氯离子、铝离子、钠离子,铝离子和碳酸根不共存,故B错误;
C.Fe3+和HCO3-发生双水解,故C错误;
D.d点溶液中有氯离子、偏铝离子、钠离子,与所有离子都不反应,故D正确.
故选D.
B.b点溶液中有氯离子、铝离子、钠离子,铝离子和碳酸根不共存,故B错误;
C.Fe3+和HCO3-发生双水解,故C错误;
D.d点溶液中有氯离子、偏铝离子、钠离子,与所有离子都不反应,故D正确.
故选D.
点评:本题以图象形式考查混合物的有关计算,清楚各阶段发生的反应是关键,题目难度不大.

练习册系列答案
 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案
相关题目
下列表示对应化学反应的离子方程式正确的是( )
| A、盐酸中加入碳酸钙:CO32-+2H+═H2O+CO2↑ |
| B、向Ba(OH)2溶液中滴加NaHSO4溶液至恰好为中性:Ba2++OH-+H++SO42-=BaSO4↓+H2O |
| C、用小苏打治疗胃酸过多:HCO3-+H+=CO2↑+H2O |
| D、AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ |
准确量取25.00mL KMnO4溶液于锥形瓶中并用某无色未知浓度的还原性A溶液进行滴定,所选仪器和指示剂均正确的是( )
| A、50 mL酸式滴定管;甲基橙 |
| B、50 mL碱式滴定管;酚酞 |
| C、50 mL量筒;石蕊 |
| D、50 mL酸式滴定管;不用指示剂 |
 某学习小组利用中和反应原理和DIS系统测定某氨水的物质的量浓度,以测量溶液导电能力来判断滴定终点.实验步骤如下:
某学习小组利用中和反应原理和DIS系统测定某氨水的物质的量浓度,以测量溶液导电能力来判断滴定终点.实验步骤如下: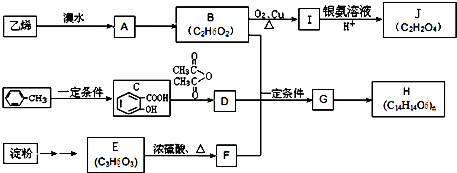 6
6
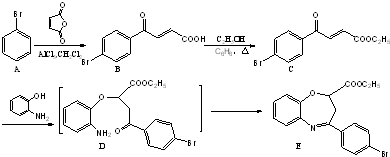
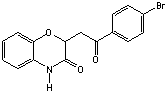 和一种常见的有机物F,F的结构简式为
和一种常见的有机物F,F的结构简式为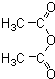
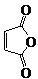 俗名“马莱酐”,它是马莱酸(顺丁烯二酸:)的酸酐.
俗名“马莱酐”,它是马莱酸(顺丁烯二酸:)的酸酐.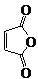 为原料制备化合物
为原料制备化合物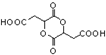 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下: