��Ŀ����
7����KMnO4�����ܶ�Ϊ1.19g•cm-3��������������Ϊ36.5%��HCl��Һ����Ӧ����ʽ���£�2KMnO4+16HCl�T2KCl+2MnCl2+5Cl2��+8H2O ��д��������̣���1��15.8gKMnO4��ʹ���ٿ�HCl����������Ӧ���ж��ٿ�HCl��������
��2����Cl2�ڱ�״���µ��ܶ�Ϊ3.17g•L-1���������Cl2 �ڱ�״���µ����Ϊ���٣�
���� ����n=$\frac{m}{M}$����KMnO4�����ʵ��������ݷ���ʽ��������HCl�����ʵ������������������ʵ�����
��1������m=nM��������HCl����������������HCl����������������ԭ���غ���㱻����HCl��������
��2������m=nM����������������������V=$\frac{m}{��}$���������������
��� �⣺n��KMnO4��=$\frac{15.8g}{158g/mol}$=0.1mol��
2KMnO4+16HCl=2KCl+2MnCl2+5Cl2��+8H2O
2mol 16mol 5mol
0.1mol n��HCl�� n��Cl2��
��n��HCl��=$\frac{0.1mol��16mol}{2mol}$=0.8mol��n��Cl2��=$\frac{0.1mol��5mol}{2mol}$=0.25mol��
��1���μӷ�ӦHCl����Ϊ��m��HCl��=0.8mol��36.5g/mol=29.2g��
��������HCl����������������ԭ���غ㣬n��HCl��������=2n��Cl2��=0.5mol���� m��HCl��������=0.5mol��36.5g/mol=18.25g��
��15.8g KMnO4��ʹ29.2gHCl������Ӧ����18.25gHCl��������
��2��m��Cl2��=0.25mol��71g/mol=17.75g����V��Cl2��=$\frac{m}{��}$=$\frac{17.75g}{3.17g/L}$��5.6L��
�𣺲�����Cl2�ڱ�״���µ������5.6L��
���� ���⿼�黯ѧ����ʽ�ļ��㡢������ԭ��Ӧ���㣬ע���Ԫ�ػ��ϼ۱仯����������ԭ��Ӧ������������������ʵ����йؼ��㣮

| A�� | 1 L 0.1 mol•L-1���Ҵ���Һ�з�������Ϊ0.1NA | |
| B�� | ���³�ѹ�£�28 g��ϩ���еĵ�����Ϊ16NA | |
| C�� | 44g���������Ͷ���Ļ�����й�����̼ԭ����Ϊ2 NA | |
| D�� | m g��ϩ����ϩ�Ļ�����й��õ��Ӷ���Ϊ$\frac{3m}{14}$NA |
| A�� | ��״���£�22.4 L H2O���з�����ΪNA | |
| B�� | ��������ΪNA��N2��CO����������ԼΪ22.4 L������Ϊ28 g | |
| C�� | ���³�ѹ�£�1.6 g CH4��ԭ����Ϊ0.5NA | |
| D�� | 4 g�����Ʊ�ɸ�����ʱʧȥ�ĵ�����ĿΪ0.1 NA |

��1����ҵ�����в����ĺ�SO2������ʯ�����պ��������Ƴ�����ƣ�д����Ӧ����ʽ2SO2+2Ca��OH��2+O2=2CaSO4+2H2O��
��2��װ�â��У���һ�������£��������������������Ӧʱ���¶�����������ת���ʵĹ�ϵ�����ʾ��
| �¶�/�� | 400 | 500 | 600 |
| SO2ת����/% | 99.2 | 93.5 | 73.7 |
�ڹ��ڴ˷�Ӧ����˵����ȷ����ac������ĸ����
a���÷�Ӧ��H��0
b����Ӧ�ﵽƽ��ʱ��SO2��O2��SO3 ��Ũ��һ�������
c����Ӧ�ﵽƽ��״̬ʱ��v��SO2����=2v��O2����
d�������¶Ȼ�ʹ�ô����������SO2��ת����
�����᳧β������Ҫ�ɷ�ΪSO2��O2��N2���е�Ũ��SO2�������кܶ�����ð�ˮ��������β������β����
SO2�백ˮǡ�÷�Ӧ�õ������Եģ�NH4��2SO3��Һ�����йظ���Һ�����й�ϵ��ȷ����ac ������ĸ����
a��c��NH4+��+c��NH3•H2O��=2[c��SO32-��+c��HSO3-��+c��H2SO3��]
b��c��NH4+��+c ��H+��=c ��SO32-��+c ��HSO3-��+c ��OH-��
c��c��NH4+����c ��SO32-����c ��OH-����c ��H+��
��3��װ�â��У�һ����̼��������Ӧ���ɼ״�������ΪCu2O/ZnO����
��֪����2CO��g��+O2��g���T2CO2��g����H=-283kJ•mol-1
��2H2��g��+O2��g���T2H2O��l����H=-571.6kJ•mol-1
��2CH3OH��l��+3O2��g���T2CO2��g��+4H2O ��l����H=-725.8kJ•mol-1
��д��CO��H2��һ�������·�Ӧ����CH3OH��l�����Ȼ�ѧ����ʽCO��g��+2H2��g��=CH3OH��l����H=-350.2kJ•mol-1��
��4���ڹ�̬��������������У�һ��������H2O-CO2��������Ʊ�H2��CO��һ���µ���Դ���÷�ʽ������ԭ����ͼ2��ʾ��
��Y���ǵ�Դ��������������������
�������ĵ缫��ӦʽΪ CO2+2e��=CO+O2����H2O+2e-�TH2��+O2-��
 ����������£�
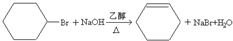
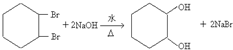
����������£�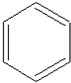 $��_{FeBr_{3}}^{Br_{2}}$A$��_{Ni��}^{H_{2}}$��C��D��
$��_{FeBr_{3}}^{Br_{2}}$A$��_{Ni��}^{H_{2}}$��C��D��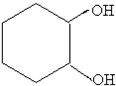
 ��
�� ��
�� ��
�� ��
�� ijѧ����0.100mol•L-1��KOH����Һ�ζ�δ֪Ũ�ȵ����ᣬ������ɷֽ�Ϊ���¼�����
ijѧ����0.100mol•L-1��KOH����Һ�ζ�δ֪Ũ�ȵ����ᣬ������ɷֽ�Ϊ���¼�����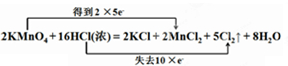 ��
��