题目内容
19.实验室可用KMnO4固体和浓盐酸反应制氯气,反应的化学方程式如下:2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2+8H2O(1)用双线桥法标出该反应电子转移的方向和数目
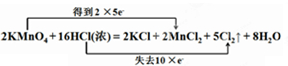 ;
;(2)该反应中氧化剂是KMnO4,还原剂是HCl.
(3)若反应中有0.20mol电子发生转移,生成氯气的体积为2.24L(标准状况),被氧化的HCl的物质的量是0.20mol.
分析 (1)依据元素化合价变化升降数值,结合氧化还原反应的双线桥标出电子转移方向和数目;
(2)根据化合价的升降判断氧化剂、还原剂;利
(3)用电子的转移与气体的关系计算上生成的气体,先判断参加氧化还原反应的盐酸,再根据电子转移的量计算被氧化的盐酸.
解答 解:(1)2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2+8H2O,锰元素化合价从+7价降低到+2价;16HCl参与反应其中10HCl中氯元素化合价从-1价升高为0价;双线桥表示为: ,
,
故答案为: ;
;
(2)2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O,Mn元素由+7价降低到+2价,Cl元素的化合价由-1价升高到0,
高锰酸钾得电子是氧化剂,HCl失电子是还原剂,故答案为:KMnO4;HCl;
(2)设反应中有0.20mol 电子发生转移,生成氯气的体积为x,被氧化的HCl的物质的量是y;
2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O 转移电子10e-,
所以电子与氯气的关系式为10e-~5Cl2
10mol 5×22.4L
0.20mol x
x=2.24L,
所以生成气体是2.24L;
每生成5mol氯气被氧化的HCl是10mol
2KMnO4+10HCl(浓)+6HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O 转移电子10e-,
所以被氧化的 HCl与转移电子之间的关系式为
10HCl~10e-
10 10
y 0.20mol
y=0.20mol,
所以被氧化的HCl为0.20mol,
故答案为:2.24L;0.20mol.
点评 本题考查学生氧化还原反应的有关知识以及相关计算问题,侧重于学生的分析能力和计算能力的考查,为高频考点,注意从元素化合价的角度认识氧化还原反应的相关概念和物质的性质,难度不大,注意灵活应用.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 热稳定性:HF>HCl>HBr>HI | B. | 微粒半径:K+>Na+>Mg2+>Al3+ | ||
| C. | 酸性:HClO4>H2SO4>H3PO4>H2SiO3 | D. | 第一电离能:Na<Mg<Al<Si |
| A. |  萃取溴水中的溴 | B. |  配置一定浓度的硫酸 | ||
| C. |  由酒精制无水酒精 | D. |  点燃酒精灯 |
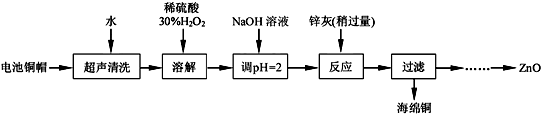
(1)①写出铜帽溶解过程中发生反应的化学方程式Cu+H2O2+H2SO4=CuSO4+2H2O.
②铜帽溶解后需将溶液中过量H2O2除去.除去H2O2的简便方法是加热至沸.
(2)为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)含量,实验中需测定除去H2O2后溶液中Cu2+的含量.实验操作为:准确量取一定体积的含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节pH=3~4,加入过量KI,用Na2S2O3标准溶液滴定至终点.上述过程中的离子方程式如下:
2Cu2++4I-═2CuI(白色)↓+I2 I2+2$S_2^{\;}O_3^{2-}$═2I-+$S_4^{\;}O_6^{2-}$
①滴定选用的指示剂为淀粉溶液,滴定终点观察到的现象为蓝色褪去并半分钟内不恢复.
②若滴定前溶液中H2O2没有除尽,所测得的Cu2+的含量将会偏高(填“偏高”、“偏低”、“不变”).
(3)已知pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-.下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算)
| Fe3+ | Fe2+ | Zn2+ | |
| 开始沉淀的pH | 1.1 | 5.8 | 5.9 |
| 完全沉淀的pH | 3.2 | 8.8 | 8.9 |
由回收铜后的滤液制备ZnO的实验步骤依次为:
①向滤液中加入略过量30%的H2O2,使其充分反应;
②向反应后的溶液中滴加1.0moL•L-1的NaOH溶液,调节溶液的pH约为5(或3.2≤pH<5.9);
③过滤;
④向滤液中滴加1.0moL•L-1的氢氧化钠,调节pH约为10(或8.9≤pH≤11);
⑤过滤、洗涤、干燥
⑥900℃煅烧.
| A. | 离子化合物可能含共价键 | B. | 共价化合物可能含离子键 | ||
| C. | 离子化合物中只含离子键 | D. | 共价化合物中只含离子键 |
 氮是重要的非金属元素,其单质用途之一是制取氨气,反应方程式为:N2(g)+3H2(g)?2NH3(g):回答下列问题:
氮是重要的非金属元素,其单质用途之一是制取氨气,反应方程式为:N2(g)+3H2(g)?2NH3(g):回答下列问题: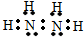 .
.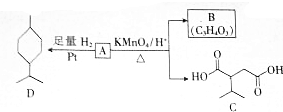
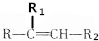 $→_{△}^{KMnO_{4}/H+}$
$→_{△}^{KMnO_{4}/H+}$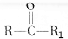 +R2COOH
+R2COOH .A与等物质的量的溴单质反应的产物有3种.
.A与等物质的量的溴单质反应的产物有3种. .
.