题目内容
下列说法正确的是( )
| A、向装有Fe(NO3)2溶液的试管中加入稀H2SO4,在管口观察到红棕色气体,结论:NO3-被还原为NO2 |
| B、SO2能使加了酚酞的NaOH溶液褪色,加热,溶液立即再变红色 |
| C、通过摇晃试剂瓶可区分浓硫酸和稀硫酸 |
| D、浓硝酸有强氧化性,常温下能与Fe发生反应 |
考点:硝酸的化学性质,含氮物质的综合应用,二氧化硫的化学性质,浓硫酸的性质
专题:氧族元素,氮族元素
分析:A.NO3-在酸性条件下具有氧化性,被还原生成NO,NO被O2氧化为红棕色的NO2;
B.SO2能使加了酚酞的NaOH溶液褪色的原理是消耗氢氧化钠,使溶液碱性减弱;
C.根据溶液的粘稠度分析;
D.浓硝酸有强氧化性,常温下能与Fe发生钝化.
B.SO2能使加了酚酞的NaOH溶液褪色的原理是消耗氢氧化钠,使溶液碱性减弱;
C.根据溶液的粘稠度分析;
D.浓硝酸有强氧化性,常温下能与Fe发生钝化.
解答:
解:A.向Fe(NO3)2溶液中加入H2SO4,则会发生离子反应:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,产生的NO在管口生成NO2呈现红色,而不是NO3-被还原为NO2,故A错误;
B.因为,二氧化硫只能漂白有机色素,所以SO2能使加了酚酞的NaOH溶液褪色的原理是与氢氧化钠反应使溶液碱性减弱,而不是漂白红色,故B错误;
C.因为浓硫酸的粘稠度大,稀硫酸的粘稠度小,所以可以摇晃试剂瓶观察粘稠度区分浓硫酸和稀硫酸,故C正确;
D.浓硝酸有强氧化性,常温下能与Fe发生钝化,所以不会继续反应,故D错误.
故选C.
B.因为,二氧化硫只能漂白有机色素,所以SO2能使加了酚酞的NaOH溶液褪色的原理是与氢氧化钠反应使溶液碱性减弱,而不是漂白红色,故B错误;
C.因为浓硫酸的粘稠度大,稀硫酸的粘稠度小,所以可以摇晃试剂瓶观察粘稠度区分浓硫酸和稀硫酸,故C正确;
D.浓硝酸有强氧化性,常温下能与Fe发生钝化,所以不会继续反应,故D错误.
故选C.
点评:本题考查硫酸、硝酸的一些现在,注意物质的性质和物质的检验方法,难度不大,注重基础知识的积累.

练习册系列答案
相关题目
下列分离或提纯物质的方法正确的是( )
| A、用渗析的方法精制Fe(OH)3胶体 |
| B、用过滤的方法除去NaCl溶液中含有的少量淀粉胶体 |
| C、用溶解、过滤的方法提纯含有少量BaSO4的BaCO3 |
| D、用加热蒸发结晶的方法从AlCl3溶液得到AlCl3 |
在298K时,2SO2(g)+O2(g)?2SO3(g)△H=-197kJ?mol-1,在相同的温度下,向密闭真空容器中通入2molSO2和1molO2,达到平衡时放出热量Q1; 向另一个同体积的密闭真空容器中通入1molSO2和0.5molO2,达到平衡时放出热量Q2,则下列关系中正确的是( )
A、Q2<
| ||
B、Q2=
| ||
C、Q2>
| ||
| D、Q1=Q2=197kJ |
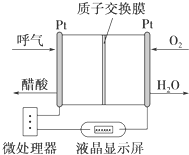 如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测.下列说法不正确的是( )
如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测.下列说法不正确的是( )| A、电流由O2所在的铂电极经外电路流向另一电极 |
| B、O2所在的铂电极处发生还原反应 |
| C、该电池的负极反应式为:CH3CH2OH+3H2O-12e-═2CO2↑+12H+ |
| D、微处理器通过检测电流大小而计算出被测气体中酒精的含量 |
常温下,下列各组粒子在指定溶液中能量共存的是( )
| A、在酸性KMnO4溶液中:Na+、C2H5OH、NH4+、Cl- |
| B、能溶解CaCO3的溶液中:Fe2+、Ca2÷、Cl-、NO3- |
| C、澄清透明的溶液中:Cu2+、Mg2+、SO42-、Cl- |
| D、能使淀粉-KIO3试纸显蓝色的溶液中:K+、H+、SO42-、I- |
下列描述中正确的是( )
| A、已知C(金刚石,s)=C(石墨,s)△H<0,则金刚石比石墨稳定 |
| B、CO(g)的燃烧热是283.0 kJ?mol-1,则2CO2(g)=2CO(g)+O2(g)的△H=2×(+283.0)kJ?mol-1 |
| C、HCl和NaOH反应的中和热△H=-57.3 kJ?mol-1,则H2SO4和Ba(OH)2的反应热△H=2×(-57.3)kJ?mol-1 |
| D、1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 |
