题目内容
16.世界环保联盟建议全面禁止使用氯气用于饮用水的消毒,而建议采用高效“绿色”消毒剂二氧化氯.二氧化氯是一种极易爆炸的强氧化性气体,易溶于水、不稳定、呈黄绿色,在生产和使用时必须尽量用稀有气体进行稀释,同时需要避免光照、震动或加热.实验室以电解法制备ClO2的流程如图: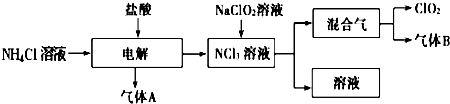
(1)ClO2中所有原子C(填“是”或“不是”)都满足8电子结构.图所示电解法制得的产物中杂质气体B能使石蕊试液显蓝色,除去杂质气体可选用C.
A.饱和食盐水 B.碱石灰 C.浓硫酸 D.蒸馏水
(2)稳定性二氧化氯是为推广二氧化氯而开发的新型产品,下列说法正确的是ABCD.
A.二氧化氯可广泛用于工业和饮用水处理
B.应用在食品工业中能有效地延长食品贮藏期
C.稳定性二氧化氯的出现大大增加了二氧化氯的使用范围
D.在工作区和成品储藏室内,要有通风装置和监测及警报装置
(3)欧洲国家主要采用氯酸钠氧化浓盐酸制备.化学反应方程式为2NaClO3+4HCl(浓)═2NaCl+Cl2↑+2ClO2↑+2H2O.缺点主要是产率低、产品难以分离,还可能污染环境.
(4)我国广泛采用经干燥空气稀释的氯气与固体亚氯酸钠(NaClO2)反应制备,化学方程式是2NaClO2+Cl2═2NaCl+2ClO2,此法相比欧洲方法的优点是安全性好,没有产生毒副产品.
(5)科学家又研究出了一种新的制备方法,利用硫酸酸化的草酸(H2C2O4)溶液还原氯酸钠,化学反应方程式为H2C2O4+2NaClO3+H2SO4═Na2SO4+2CO2↑+2ClO2↑+2H2O.此法提高了生产及储存、运输的安全性,原因是反应过程中生成的二氧化碳起到稀释作用.
分析 (1)Cl最外层7个电子,只有1个单电子,O最外层6个电子,含2个单电子;产物中杂质气体B能使石蕊试液显蓝色,为氨气,可选酸来除杂;
(2)高效“绿色”消毒剂二氧化氯,可推广使用,代替氯气;
(3)氯酸钠氧化浓盐酸生成氯化钠、氯气、二氧化氯、水;
(4)氯气与固体亚氯酸钠(NaClO2)反应,生成氯化钠和二氧化氯;
(5)用硫酸酸化的草酸(H2C2O4)溶液还原氯酸钠,反应生成硫酸钠、二氧化碳、二氧化氯、水,以此来解答.
解答 解:(1)Cl最外层7个电子,只有1个单电子,O最外层6个电子,含2个单电子,则O原子不能满足8电子稳定结构,产物中杂质气体B能使石蕊试液显蓝色,为氨气,可选酸来除杂,只有C中浓硫酸符合,
故答案为:不是;C;
(2)A.二氧化氯可广泛用于工业和饮用水处理,代替氯气,为“绿色”消毒剂,故A正确;
B.应用在食品工业中能有效地延长食品贮藏期,能杀菌消毒,故B正确;
C.稳定性二氧化氯的出现大大增加了二氧化氯的使用范围,便于运输和应用,故C正确;
D.二氧化氯是一种极易爆炸的强氧化性气体,在工作区和成品储藏室内,要有通风装置和监测及警报装,故D正确;
故答案为:ABCD;
(3)氯酸钠氧化浓盐酸生成氯化钠、氯气、二氧化氯、水,该反应为:2NaClO3+4HCl(浓)═2NaCl+Cl2↑+2ClO2↑+2H2O,
故答案为:2NaClO3+4HCl(浓)═2NaCl+Cl2↑+2ClO2↑+2H2O;
(4)氯气与固体亚氯酸钠(NaClO2)反应,生成氯化钠和二氧化氯,该反应为2NaClO2+Cl2═2NaCl+2ClO2,该法相比欧洲方法的优点为安全性好,没有产生毒副产品,
故答案为:2NaClO2+Cl2═2NaCl+2ClO2;安全性好,没有产生毒副产品;
(5)用硫酸酸化的草酸(H2C2O4)溶液还原氯酸钠,反应生成硫酸钠、二氧化碳、二氧化氯、水,该反应为H2C2O4+2NaClO3+H2SO4═Na2SO4+2CO2↑+2ClO2↑+2H2O,
此法提高了生产及储存、运输的安全性,原因是反应过程中生成的二氧化碳起到稀释作用,
故答案为:H2C2O4+2NaClO3+H2SO4═Na2SO4+2CO2↑+2ClO2↑+2H2O;反应过程中生成的二氧化碳起到稀释作用.
点评 本题考查制备方案的设计,题目难度中等,注意把握所给信息来分析解答,侧重学生解决新问题能力的考查,将知识活学活用为解答的关键,试题培养了学生的化学实验能力.

 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案
已知:①+3价Cr在酸性溶液中性质稳定,当pH>9时以CrO2-形式存在且易氧化;
②常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下.
| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cr3+ |
| 开始沉淀时的pH | 2.7 | 7.6 | 9.0 | -- | -- |
| 沉淀完全时的pH | 3.7 | 9.6 | 11.0 | 8(>8溶解) | 9(>9溶解) |
(2)如果把“调pH=8”和“调pH>11”中间的“过滤”步骤省略,引起的后果是pH>11时Al(OH)3会溶解,引入杂质离子AlO2-,使产品不纯.
(3)流程图中“□”内的操作是蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
(4)工业废水中的Na2CrO4遇酸时可转化为Na2Cr2O7,含Cr2O72-的废水毒性较大,为了使废水的排放达标,进行如下处理:

①绿矾化学式为FeSO4•7H20,反应(Ⅰ)的离子方程式为Cr2O72-+6Fe2++14H+=6Fe3++2Cr3++7H2O.
②若处理后的废水中c(Cr3+)=3.0×10-6mol•L-1,则废水中c(Fe3+)=2×10-13mol•L-1.
(Ksp[Fe(OH)3])=4.0×10-38,Ksp[Cr(OH)3]=6.0×10-31)
(5)某工厂为了测定重铬酸钠样品的纯度,称取重铬酸钠试样2.500g配成250mL溶液,取出25.00mL于碘量瓶中,加入10mL 2mol•L-1H2SO4和足量碘化钠(铬的还原产物为Cr3+),放于暗处5min,然后加入100mL水,再加入淀粉溶液作指示剂,用0.1200mol•L-1Na2S2O3标准溶液滴定(I2+2S2O32-=2I-+S4O62-).
①判断达到滴定终点的依据是当滴加最后一滴硫代硫酸钠溶液时,溶液蓝色褪去,半分钟内不变色;
②若实验中共用去Na2S2O3标准溶液40.00ml,则该工厂的重铬酸钠样品的纯度为(设整个过程中其它杂质不参与反应)83.84%.
| A. | 密度:苯<水<溴苯 | B. | 沸点:戊烷>2-甲基丁烷>丙烷 | ||
| C. | 酸性:HCO3-<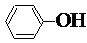 <H2CO3 <H2CO3 | D. | 与Na反应的速率:水>苯酚>乙醇 |

| A. | 溶液pH≤2时,生铁发生吸氧腐蚀 | |
| B. | 在酸性溶液中生铁只能发生析氢腐蚀 | |
| C. | 析氢腐蚀和吸氧腐蚀的速率一样快 | |
| D. | 两溶液中负极反应均为Fe-2e-=Fe2+ |
| A. | CH3CH2CH2OH | B. | (CH3)3CCH2OH | C. | HOCH2CHBrCH3 | D. | CH3OH |

 CH2-CHCl
CH2-CHCl .
.
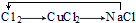
 ,CCH3CH3,D
,CCH3CH3,D .
.