题目内容
5.很多纪念金币材料为钢芯镀金,你认为制作这种金纪念币时,钢芯应作( )| A. | 阴极 | B. | 阳极 | C. | 正极 | D. | 负极 |
分析 由电解原理可知,阳极上金失去电子,阴极上金离子得到电子,可实现钢芯上镀金,以此来解答.
解答 解:制作这种金纪念币时,钢芯应与电源负极相连,作阴极,而金与电源正极相连,阳极上金失去电子,阴极上金离子得到电子,可实现钢芯上镀金,
故选A.
点评 本题考查电解原理及应用,为高频考点,把握电解原理、电极反应为解答的关键,侧重分析与应用能力的考查,注意化学与生活的联系,题目难度不大.

练习册系列答案
 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案
相关题目
5.W、X、Y、Z均为短周期主族原子,原子序数依次增大,其原子的最外层电子数之和为18,W和Y同主族,X原子的电子层数与最外层电子数相等,Z元素最高正价与最低负价的绝对值之差为6,下列说法不正确的是( )
| A. | W的一种单质的沸点比X的高 | |
| B. | 氧化物的水化物的酸性:Z>W | |
| C. | W与Y可形成一种硬度很大的化合物 | |
| D. | W、X、Y三种元素均可以与Z元素形成共价化合物 |
16.下列物质的方程式正确的是( )
| A. | H2O3?2H++CO32- | B. | CH3COO-+H2O?CH3COOH+OH- | ||
| C. | NaHCO3?Na++HCO3- | D. | BaOH)2?Ba2++2OH- |
13. 中和热测定实验中,用50mL0.50mol/L盐酸和50mL0.55mol/LNaOH溶液进行实验,下列说法不正确的是( )
中和热测定实验中,用50mL0.50mol/L盐酸和50mL0.55mol/LNaOH溶液进行实验,下列说法不正确的是( )
 中和热测定实验中,用50mL0.50mol/L盐酸和50mL0.55mol/LNaOH溶液进行实验,下列说法不正确的是( )
中和热测定实验中,用50mL0.50mol/L盐酸和50mL0.55mol/LNaOH溶液进行实验,下列说法不正确的是( )| A. | 改用25mL 0.50mol/L盐酸跟25mL 0.55 mol/L NaOH溶液进行反应,求出的中和热数值和原来相同 | |
| B. | 酸碱混合时,量筒中NaOH溶液应缓缓倒入小烧杯中,不断用玻璃棒搅拌 | |
| C. | 装置中的大小烧杯之间填满碎泡沫塑料的作用是保温隔热减少热量损失 | |
| D. | 实验中应记录测量出的最高温度 |
20.短周期元素X、Y、Z、W的原子序数依次增大.它们分别位于不同的主族,X的最高正价与最低负价代数和为0,Y为金属元素,Y与Z最外层电子数之和与W的相等,X与W所在族序数之和等于10.下列说法正确的是( )
| A. | 原子半径大小顺序:W>Z>Y>X | |
| B. | X、Y、W都能与氧元素形成两种氧化物 | |
| C. | W的最高价氧化物的水化物的酸性比Z的弱 | |
| D. | W分别与X、Y形成的化合物中化学键类型相同 |
10.某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.
Ⅰ.配制0.50mol/L NaOH溶液
(1)若实验中大约要使用245mL NaOH溶液,至少需要称量NaOH固体5.0g.
(2)从图1中选择称量NaOH固体所需要的仪器是(填字母):abe.
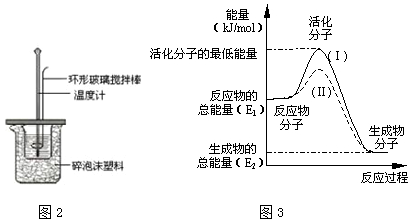
Ⅱ.测定中和热的实验装置如图2所示.
(1)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式$\frac{1}{2}$H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol(中和热数值为57.3kJ/mol):
(2)取50mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如表.
①请填写表中的空白:
②近似认为0.50mol/L NaOH溶液和0.50mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g•℃).则中和热△H=-53.5kJ/mol(取小数点后一位).
(3)在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子称为活化分子,使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ/mol表示.请认真观察3图,然后回答问题.
①图中所示反应是放热(填“吸热”或“放热”)反应,该反应的△H=(E2-E1)kJ/mol(用含E1、E2的代数式表示).
②对于同一反应,图3中虚线(Ⅱ)与实线(Ⅰ)相比,活化能大大降低,活化分子的百分数增多,反应速率加快,你认为最可能的原因是使用了催化剂.
Ⅰ.配制0.50mol/L NaOH溶液
(1)若实验中大约要使用245mL NaOH溶液,至少需要称量NaOH固体5.0g.
(2)从图1中选择称量NaOH固体所需要的仪器是(填字母):abe.
| 名称 | 托盘天平(带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 | 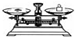 |  |  |  |  |  |
| 序号 | a | b | c | d | e |

(1)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式$\frac{1}{2}$H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol(中和热数值为57.3kJ/mol):
(2)取50mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如表.
①请填写表中的空白:
| 实验次数 | 起始温度t1/℃ | 终止温度 t2/℃[ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
(3)在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子称为活化分子,使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ/mol表示.请认真观察3图,然后回答问题.
①图中所示反应是放热(填“吸热”或“放热”)反应,该反应的△H=(E2-E1)kJ/mol(用含E1、E2的代数式表示).
②对于同一反应,图3中虚线(Ⅱ)与实线(Ⅰ)相比,活化能大大降低,活化分子的百分数增多,反应速率加快,你认为最可能的原因是使用了催化剂.
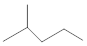 表示的分子式C6H14;名称是2-甲基戊烷.
表示的分子式C6H14;名称是2-甲基戊烷.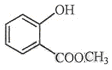 中含氧的官能团的名称为羟基,酯基.
中含氧的官能团的名称为羟基,酯基.