题目内容
14.室温下,1mol•L-1的二元酸H2A溶液体系中存在的所有含A粒子(HA-、A2-)所占的物质的量分数(δ)随pH变化的关系如图所示,下列说法不正确的是( )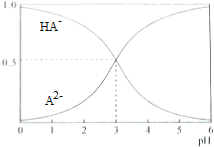
| A. | pH=5时,c(HA-)>c(A2-)>c(H+)>c(OH-) | |
| B. | 在Na2A溶液中存在c(Na+)=2c(A2-)+2c(HA-) | |
| C. | 等物质的量浓度的NaHA和Na2A混合溶液中,c(Na+)>c(A2-)>c(HA-) | |
| D. | 电离平衡HA-?A2-+H+的平衡常数Ka=10-3 |
分析 A.pH=5时,溶液呈酸性,溶液中c(HA-)>c(A2-),HA-的电离程度大于A2-水解程度,但其电离和水解程度都较小;
B.在任何电解质溶液中都存在物料守恒,根据物料守恒判断;
C.等物质的量浓度的NaHA和Na2A混合溶液呈酸性,说明HA-的电离程度大于A2-水解程度,结合物料守恒判断;
D.根据pH=3时计算其电离平衡常数.
解答 解:A.pH=5时,溶液呈酸性,溶液中c(HA-)>c(A2-),HA-的电离程度大于A2-水解程度,但其电离和水解程度都较小,所以离子浓度大小为c(HA-)>c(A2-)>c(H+)>c(OH-),故A正确;
B.在任何电解质溶液中都存在物料守恒,根据物料守恒得c(Na+)=2c(A2-)+2c(HA-)+2c(H2A),故B错误;
C.等物质的量浓度的NaHA和Na2A混合溶液呈酸性,说明HA-的电离程度大于A2-水解程度,所以c(A2-)>c(HA-),结合物料守恒得c(Na+)>c(A2-)>c(HA-),故C正确;
D.电离平衡常数只与温度有关,所以pH=3时电离平衡HA-?A2-+H+的平衡常数Ka=$\frac{c({H}^{+}).c({A}^{2-})}{c(H{A}^{-})}$=$\frac{1{0}^{-3}×0.5}{0.5}$=10-3,故D正确;
故选B.
点评 本题以酸碱混合溶液定性判断为载体考查离子浓度大小比较、电离平衡常数有关计算等知识点,明确溶液中溶质及其性质、电解质溶液酸碱性是解本题关键,注意守恒思想的灵活运用,题目难度不大.

练习册系列答案
 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案 小天才课时作业系列答案
小天才课时作业系列答案
相关题目
4.Mg在CO2中燃烧生成MgO和C,下列说法正确的是( )
| A. | 碳只存在金刚石和石墨两种同素异形体 | |
| B. | Mg、MgO中微粒的半径:r(O2-)>r(Mg2+)>r(Mg) | |
| C. | 在该反应条件下,Mg的还原性强于C的还原性 | |
| D. | 相同质量的镁在足量的CO2和O2中完全燃烧,固体质量增重相等 |
2.明代宋应星著的《天工开物》中有关于“火法”冶炼锌的工艺记载:“炉甘石十斤,装载入一泥罐内,…然后逐层用煤炭饼垫盛,其底铺薪,发火煅红,…,冷淀,毁罐取出,…,即倭铅也.”下列说法不正确的是(注:炉甘石的主要成分为碳酸锌)( )
| A. | 该冶炼锌的反应属于置换反应 | |
| B. | 煤炭中起作用的主要成分是C | |
| C. | 冶炼Zn的反应方程式为:ZnCO3+2C$\frac{\underline{\;高温\;}}{\;}$Zn+3CO↑ | |
| D. | 倭铅是指金属锌和铅的混合物 |
19.下列我国古代技术应用中,其工作原理不涉及化学反应的是( )
| A. | 黑火药爆炸 | B. | 用铁矿石炼铁 | C. | 湿法炼铜 | D. | 转轮排字 |
6.如图是电解饱和食盐水(含少量酚酞)的装置,其中c、d为石墨电极.下列说法正确的是( )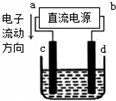

| A. | a为负极、b为正极 | B. | a为阳极、b为阴极 | ||
| C. | 电解过程中,钠离子浓度不变 | D. | 电解过程中,d电极附近变红 |
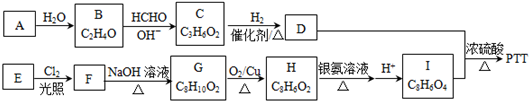
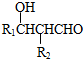
 .
. .
. .
.