题目内容
4.Mg在CO2中燃烧生成MgO和C,下列说法正确的是( )| A. | 碳只存在金刚石和石墨两种同素异形体 | |
| B. | Mg、MgO中微粒的半径:r(O2-)>r(Mg2+)>r(Mg) | |
| C. | 在该反应条件下,Mg的还原性强于C的还原性 | |
| D. | 相同质量的镁在足量的CO2和O2中完全燃烧,固体质量增重相等 |
分析 A.碳有金刚石、石墨、足球烯等多种同素异形体;
B.电子层越多半径越多,电子层相同的,质子数越多,半径越小;
C.同一氧化还原反应中,还原剂的还原性大于还原产物的还原性;
D.镁与氧气反应生成氧化镁,镁与二氧化碳反应生成氧化镁和碳.
解答 解:A.碳有金刚石、石墨、足球烯等多种同素异形体,故A错误;
B.Mg、MgO中微粒的半径:r(Mg)>r(O2-)>r(Mg2+),故B错误;
C.同一氧化还原反应中,还原剂的还原性大于还原产物的还原性,该反应中Mg是还原剂、C是还原产物,所以Mg的还原性大于C,故C正确;
D.相同质量的镁在足量的CO2和O2中完全燃烧,在二氧化碳中燃烧时固体质量增重的多与在氧气中燃烧增重,故D错误;
故选:C.
点评 本题考查了元素化合物知识,熟悉碳的同素异形体、镁的性质是解题关键,注意微粒半径大小比较的一般规律,题目难度不大.

练习册系列答案
相关题目
14.以下各组物质的溶液,不管如何滴加,反应不能用同一离子方程式表示的是( )
| A. | FeCl3与Na2S | B. | Ca(HCO3)2与Ca(OH)2 | C. | HCl与NaHCO3 | D. | AgNO3与NH3•H2O |
15.有关浓硫酸的性质或作用,叙述错误的是( )
| A. | 浓硫酸的脱水性是化学性质 | |
| B. | 使铁、铝钝化表现了强氧化性 | |
| C. | 制备乙酸乙酯的反应中起催化脱水作用 | |
| D. | 与氯化钠固体共热制氯化氢气体时,表现强酸性 |
19.能用启普发生器制取的气体是( )
| A. | 氢气 | B. | 氨气 | C. | 氧气 | D. | 乙炔 |
9.分枝酸结构简式如图,下列说法正确的是( )
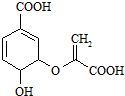

| A. | 分子式为C10H8O6 | |
| B. | 分子中含有2种官能团 | |
| C. | 可与乙醇、乙酸反应,且反应类型相同 | |
| D. | 1mol分枝酸最多可与3mol NaOH发生中和反应 |
13.如图是可逆反应A+2B?2C+3D的反应速率随反应时间变化的示意图,由此可推断( )
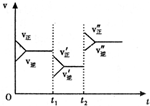

| A. | t1时若是降温使速率变化,则正确反应是放热反应 | |
| B. | t2时若是加压使速度变化,则A、B、C、D均为气体 | |
| C. | t2时改变的条件可能是加入催化剂 | |
| D. | t2时改变的条件可能是增大反应物的浓度 |
14.室温下,1mol•L-1的二元酸H2A溶液体系中存在的所有含A粒子(HA-、A2-)所占的物质的量分数(δ)随pH变化的关系如图所示,下列说法不正确的是( )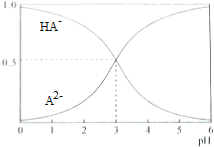

| A. | pH=5时,c(HA-)>c(A2-)>c(H+)>c(OH-) | |
| B. | 在Na2A溶液中存在c(Na+)=2c(A2-)+2c(HA-) | |
| C. | 等物质的量浓度的NaHA和Na2A混合溶液中,c(Na+)>c(A2-)>c(HA-) | |
| D. | 电离平衡HA-?A2-+H+的平衡常数Ka=10-3 |
 .
. .
.