题目内容
10.在100mL(Na2CO3)与NaAlO2的混合液中逐滴加入1mol•L-1的盐酸,测得溶液中的CO${\;}_{3}^{2-}$、HCO${\;}_{3}^{-}$、AlO${\;}_{2}^{-}$、Al3+离子的物质的量与加入盐酸溶液的体积变化关系,如图所示.下列说法正确的是( )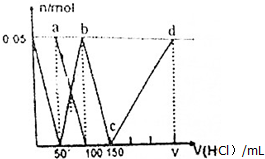
| A. | a点溶液中:c(HCO${\;}_{3}^{-}$)+c(H2CO3)+c(H+)=c(OH-) | |
| B. | 当向混合液中滴加75nL盐酸时,溶液中部分离子浓度大小顺序为:c(Na+)>c(Cl-)>c(CO${\;}_{3}^{2-}$)>c(OH-)>c(H+) | |
| C. | b点溶液中:c(Cl-)+c(HCO3-)+c(H2CO3)+c(CO${\;}_{3}^{2-}$)=1.5mol•L-1 | |
| D. | c→d的过程中水的电离程度逐渐减小 |
分析 Na2CO3、NaAlO2的混合溶液中逐滴加入1mol•L-1的盐酸,首先发生反应AlO2-+H++H2O═Al(OH)3↓,a点为表示Na2CO3、NaCl溶液;由图可知AlO2-反应完毕,加入盐酸50mL,根据方程式可知n(AlO2-)=n(H+)=0.05mol×1mol/L=0.05mol;
第二阶段AlO2-反应完毕,开始发生反应CO32-+H+═HCO3-,由图可知CO32-反应完毕,b点为NaHCO3溶液,该阶段加入盐酸100mL-50mL=50mL,根据方程式可知n(CO32-)=n(H+)=0.05mol×1mol/L=0.05mol;
第三阶段bc段:CO32-反应完毕,然后发生反应HCO3-+H+═CO2↑+H2O,由图可知HCO3-反应完毕,该阶段加入盐酸150mL-100mL=50mL,根据方程式可知n(HCO3-)=n(H+);
第四阶段,c→d的过程,发生反应Al(OH)3+3H+═Al3++3H2O,Al3+浓度逐渐增大,水的电离程度逐渐增大,据此进行解答.
解答 解:Na2CO3、NaAlO2的混合溶液中逐滴加入1mol•L-1的盐酸,首先发生反应AlO2-+H++H2O═Al(OH)3↓,a点为表示Na2CO3、NaCl溶液;由图可知AlO2-反应完毕,加入盐酸50mL,根据方程式可知n(AlO2-)=n(H+)=0.05mol×1mol/L=0.05mol;
第二阶段AlO2-反应完毕,开始发生反应CO32-+H+═HCO3-,由图可知CO32-反应完毕,b点为NaHCO3溶液,该阶段加入盐酸100mL-50mL=50mL,根据方程式可知n(CO32-)=n(H+)=0.05mol×1mol/L=0.05mol;
第三阶段bc段:CO32-反应完毕,然后发生反应HCO3-+H+═CO2↑+H2O,由图可知HCO3-反应完毕,该阶段加入盐酸150mL-100mL=50mL,根据方程式可知n(HCO3-)=n(H+);
第四阶段,c→d的过程,发生反应Al(OH)3+3H+═Al3++3H2O,Al3+浓度逐渐增大,水的电离程度逐渐增大,
A.根据分析可知,a点为碳酸钠溶液,根据质子守恒可得:c(HCO3-)+2c(H2CO3)+c(H+)=c(OH-),故A错误;
B.当向混合液中滴加75nL盐酸时,溶液中碳酸钠和碳酸氢钠的浓度相等,碳酸根离子的水解程度大于碳酸氢根离子,则c(HCO3-)>c(CO32-),所得溶液中阴离子浓度大小顺序为:c(Na+)>c(Cl-)>c(CO32-)>c(OH-)>c(H+),故B正确;
C.b点氯离子浓度为0.5mol/L,根据物料守恒c(HCO3-)+c(H2CO3)+c(CO32-)=0.25mol/L,则c(Cl-)+c(HCO3-)+c(H2CO3)+c(CO32-)=0.75 mol•L-1,故C错误;
D.c→d的过程中铝离子的浓度逐渐增大,铝离子水解促进了水的电离,则该段水的电离程度逐渐增大,故D错误;
故选B.
点评 本题考查了离子浓度大小比较、混合溶液的计算,题目难度中等,明确发生反应的先后顺序为解答关键,注意掌握电荷守恒、物料守恒及质子守恒的含义及应用方法,试题培养了学生的分析、理解能力及灵活应用能力.

| A. | CN-和N2 | B. | NO和O2 | C. | NO2和CO2 | D. | SO2和ClO2 |
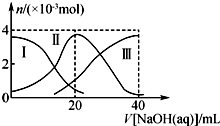 常温下,向20mL 0.2mol•L-1H2A溶液中滴加0.2mol•L-1 NaOH溶液.有关微粒的物质的量变化如右图(Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-).下列说法正确的是( )
常温下,向20mL 0.2mol•L-1H2A溶液中滴加0.2mol•L-1 NaOH溶液.有关微粒的物质的量变化如右图(Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-).下列说法正确的是( )| A. | H2A在水中的电离方程式为H2A═H++HA-,HA-?H++A2- | |
| B. | 向NaHA溶液中加水,HA-的电离度增大、溶液的pH减小 | |
| C. | V(NaOH)=20 mL时,溶液中离子浓度大小关系:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) | |
| D. | V(NaOH)=30 mL时,溶液中存在如下关系:2c(H+)-2c(OH-)=c(A2-)-3c(H2A)-c(HA-) |
| A. | 用托盘天平称取11.72g食盐 | |
| B. | 用100mL的量筒量取25.00mL盐酸 | |
| C. | 用pH试纸测得某稀醋酸溶液的pH为3.5 | |
| D. | 用0.2000mol•L-1HCl溶液滴定20.00mL未知浓度NaOH,用去22.40mL HCl溶液 |
变浑浊的时间,研究外界条件对化学反应速率的影响.设计实验如下:
| 实验编号 | 实验温度/℃ | c(Na2S2O3)/mol•L-1 | V(Na2S2O3)/mL | c(H2SO4)/mol•L-1 | V(H2SO4)/mL | V(H2O)/mL |
| ① | 25 | 0.1 | 5.0 | 0.1 | 10.0 | a |
| ② | 25 | 0.1 | 10.0 | 0.1 | 10.0 | 0 |
| ③ | 25 | 0.2 | 5.0 | 0.1 | 5.0 | b |
| ④ | 50 | 0.2 | 5.0 | 0.1 | 10.0 | 5.0 |
(2)某同学设计如下实验流程探究Na2S2O3的化学性质.

实验操作①中测试时pH试纸的颜色应该接近D.
A.红色 B.黄色 C.深蓝色 D.绿色
上述流程中实验②、③的目的是为了探究Na2S2O3某种化学性质,你认为是探究了Na2S2O3的还原性.
| A. | 离子化合物中一定含有离子键 | |
| B. | 单质分子中均存在化学键 | |
| C. | 含有极性键的分子一定是极性分子 | |
| D. | 含有共价键的化合物一定是共价化合物 |
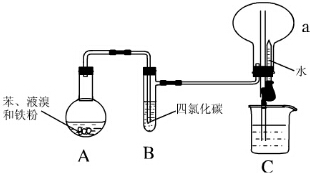 Ⅰ.某同学设计了如图所示的实验装置(夹持装置已略去)来研究苯和溴发生的反应.
Ⅰ.某同学设计了如图所示的实验装置(夹持装置已略去)来研究苯和溴发生的反应. .
.