题目内容
18.有的同学制出的肥皂中仍含有油脂,你认为是什么原因造成的?可采取哪些措施来避免这种情况的出现?分析 油脂在碱性条件下的水解为皂化反应,皂化反应不可逆,有同学制出的肥皂中含有油脂的原因是油脂的水解没有进行完全,据此分析.
解答 解:油脂在碱性条件下的水解为皂化反应,皂化反应不可逆,有同学制出的肥皂中含有油脂的原因是油脂的水解没有进行完全,原因可能是加入的NaOH的量不足或加热不充分,可以通过加入足量的氢氧化钠和充分加热来避免这种情况的出现.
答:出现这种情况的原因可能是加入的NaOH的量不足或加热不充分,可以通过加入足量的氢氧化钠和充分加热来避免这种情况的出现.
点评 本题考查了油脂的皂化反应的相关知识,应注意到油脂在碱性条件下的水解不可逆,故有油脂剩余的原因是加入的反应物的量不足或反应条件的欠缺,难度不大.

练习册系列答案
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案
相关题目
8.下列说法中正确的是( )
| A. | 因为p轨道是“8”字形的,所以p电子走“8”字形 | |
| B. | 第三电子层,有3s、3p、3d三个轨道 | |
| C. | 在一个基态多电子的原子中,不可能有两个能量完全相同的电子 | |
| D. | 一般情况下,σ键比π键重叠程度大,形成的共价键强 |
9.依据元素周期表及元素周期律,下列推断正确的是( )
| A. | H3BO3的酸性比H2CO3的强 | |
| B. | Mg(OH)2的碱性比Be(OH)2的强 | |
| C. | C、N、O原子半径依次增大 | |
| D. | 若M+和R2-的核外电子层结构相同,则原子序数:R>M |
13.一种新型燃料电池,一极通入空气.另一极通入甲烷气体;电解质是掺杂氧化钇化锆(ZrO2)晶体,在熔融状态下能传导O2-,下列对该燃料电池说法正确的是( )
| A. | 在熔融电解质中,O2-由负极移向正极 | |
| B. | 通入空气的一极是正极,电极反应为:O2+2H2O+4e-═4OH- | |
| C. | 通入甲烷的一极是负极,电极反应为:CH4+8e-+4O2-═CO2+2H2O | |
| D. | 当电路中通过amol电子时,理论上能生成标准状况下CO2气体2.8aL |
3.一定量的盐酸和过量锌粉反应时,为了减缓反应速率,且不影响生成氢气的总量,可以向盐酸中加入适量的( )
| A. | NaOH固体 | B. | 水 | C. | CuSO4固体 | D. | 氯化钠溶液 |
10.在100mL(Na2CO3)与NaAlO2的混合液中逐滴加入1mol•L-1的盐酸,测得溶液中的CO${\;}_{3}^{2-}$、HCO${\;}_{3}^{-}$、AlO${\;}_{2}^{-}$、Al3+离子的物质的量与加入盐酸溶液的体积变化关系,如图所示.下列说法正确的是( )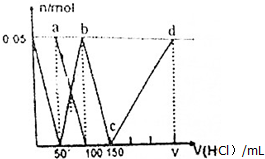

| A. | a点溶液中:c(HCO${\;}_{3}^{-}$)+c(H2CO3)+c(H+)=c(OH-) | |
| B. | 当向混合液中滴加75nL盐酸时,溶液中部分离子浓度大小顺序为:c(Na+)>c(Cl-)>c(CO${\;}_{3}^{2-}$)>c(OH-)>c(H+) | |
| C. | b点溶液中:c(Cl-)+c(HCO3-)+c(H2CO3)+c(CO${\;}_{3}^{2-}$)=1.5mol•L-1 | |
| D. | c→d的过程中水的电离程度逐渐减小 |
9.影响化学反应速率的因素很多,某课外兴趣小组用实验的方法研究反应速率的有关问题.
(1)实验1 探究Mg与盐酸反应速率的变化规律
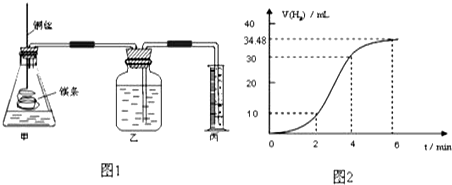
取一段镁条,用砂纸擦去表面的氧化膜,铜丝缠着镁条伸入装置甲中,使镁条浸入锥形瓶内的体积为2L稀盐酸(足量)中.镁条和盐酸反应生成H2的体积与反应时间的关系曲线如图2所示.
①从图2中看出0-6min内平均反应速率最快的时间段是B.(填代号)
A.0-2min B.2-4min C.4-6min
②请计算4-6min 时间内,用HCl表示的平均反应速率为1×10-4mol/(L•min).(假设图2氢气体积均已换算为标准状况下的体积,且溶液体积变化可忽略)
③图1装置甲中与镁条相连的铜丝若一起浸入稀盐酸中对反应速率影响下列说法正确的是(
A.加快反应速率但生成氢气的总量不变 B.减慢反应但增大生成氢气总量
C.不影响反应速率 D.加快反应速率但生成氢气的总量减小
(2)实验2 探究酸浓度对MnO2与H2O2反应速率的影响:已知MnO2+H2O2+2H+ Mn2++O2↑+2H2O,现取等量MnO2和下表有关物质,在相同温度下进行4组实验,分别记录收集20.0mL氧气所需时间.
①上表中V1=5.0mL,V3=1.5mL.
②有同学提出实验I不可作为实验Ⅱ、Ⅲ、Ⅳ的对比实验,其理由是实验I中MnO2将作为催化剂,其他三组实验中二氧化锰作氧化剂,反应原理不同,且酸量不同.
③若实验测得t2>t3>t4,则可得出的实验结论是酸浓度越大,反应速率越快.
(1)实验1 探究Mg与盐酸反应速率的变化规律

取一段镁条,用砂纸擦去表面的氧化膜,铜丝缠着镁条伸入装置甲中,使镁条浸入锥形瓶内的体积为2L稀盐酸(足量)中.镁条和盐酸反应生成H2的体积与反应时间的关系曲线如图2所示.
①从图2中看出0-6min内平均反应速率最快的时间段是B.(填代号)
A.0-2min B.2-4min C.4-6min
②请计算4-6min 时间内,用HCl表示的平均反应速率为1×10-4mol/(L•min).(假设图2氢气体积均已换算为标准状况下的体积,且溶液体积变化可忽略)
③图1装置甲中与镁条相连的铜丝若一起浸入稀盐酸中对反应速率影响下列说法正确的是(
A.加快反应速率但生成氢气的总量不变 B.减慢反应但增大生成氢气总量
C.不影响反应速率 D.加快反应速率但生成氢气的总量减小
(2)实验2 探究酸浓度对MnO2与H2O2反应速率的影响:已知MnO2+H2O2+2H+ Mn2++O2↑+2H2O,现取等量MnO2和下表有关物质,在相同温度下进行4组实验,分别记录收集20.0mL氧气所需时间.
| 实验编号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
| 10%H2O2的体积/mL | 5.0 | 5.0 | V1 | V2 |
| 20%硫酸的体积/mL | 0 | 0.5 | 1.0 | V3 |
| 水的体积/mL | 15 | 14.5 | V4 | 13.5 |
| 所需时间t/s | t1 | t2 | t3 | t4 |
②有同学提出实验I不可作为实验Ⅱ、Ⅲ、Ⅳ的对比实验,其理由是实验I中MnO2将作为催化剂,其他三组实验中二氧化锰作氧化剂,反应原理不同,且酸量不同.
③若实验测得t2>t3>t4,则可得出的实验结论是酸浓度越大,反应速率越快.
10.下列叙述中,与胶体性质无直接关系的是( )
| A. | 含有少量硫的酒精溶液,加入大量水后形成乳白色液体,用滤纸过滤不能分离出硫 | |
| B. | 原硅酸溶液中加入硫酸铵饱和溶液,结果产生沉淀 | |
| C. | 硫酸铜溶液中加入硫化钠溶液产生黑色沉淀 | |
| D. | 用水稀释牛奶,用一束强光照射,从侧面观察,可以看到一条清晰的光路 |
 合成氨是化学科学对人类社会发展与进步作出巨大贡献的典例之一,合成氨工业包括原料气的制备、净化、氨的合成及各种化肥生产等.
合成氨是化学科学对人类社会发展与进步作出巨大贡献的典例之一,合成氨工业包括原料气的制备、净化、氨的合成及各种化肥生产等.