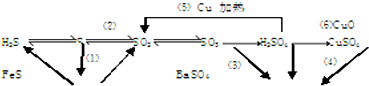
题目内容
(1)常温下,amL0.1mol/LCH3COOH与bmL0.1mol/LNaOH混合,充分反应.
①若a=b,则反应后溶液中离子浓度从大到小的顺序是
②若混合后溶液呈中性,则a b,反应后溶液中C(CH3COO-) C(Na+).(填“>”“=”或“<”)
(2)常温下,amLPH=3的CH3COOH与bmLPH=11的NaOH混合,充分反应.
①两溶液中由水电离出的H+浓度之比为
②若a=b,则反应后溶液中粒子浓度从大到小的顺序是 (H2O除外)
(3)常温下,如果取0.1mol/LHA溶液与0.1mol/L NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=10.试回答以下问题:
求出混合物中下列算式的计算结果(填具体数字):c(A-)+c(HA)= mol/L; c(OH-)-c(HA)= mol/L.
①若a=b,则反应后溶液中离子浓度从大到小的顺序是
②若混合后溶液呈中性,则a
(2)常温下,amLPH=3的CH3COOH与bmLPH=11的NaOH混合,充分反应.
①两溶液中由水电离出的H+浓度之比为
②若a=b,则反应后溶液中粒子浓度从大到小的顺序是
(3)常温下,如果取0.1mol/LHA溶液与0.1mol/L NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=10.试回答以下问题:
求出混合物中下列算式的计算结果(填具体数字):c(A-)+c(HA)=
考点:酸碱混合时的定性判断及有关ph的计算,离子浓度大小的比较
专题:电离平衡与溶液的pH专题,盐类的水解专题
分析:(1)①当a=b时,两者恰好完全中和,得CH3COONa溶液,呈碱性;
②根据CH3COONa溶液呈碱性可知,要使混合后呈中性,必须醋酸过量;根据电荷守恒来分析;
(2)①酸或碱抑制水电离,如果酸中c(H+)等于碱中c(OH-),则酸或碱抑制水电离程度相等;
②常温下,pH=3的醋酸浓度大于pH=11的NaOH浓度,如果a=b,二者反应时醋酸有剩余,溶液呈酸性,再结合电荷守恒判断c(CH3COO-)、c(Na+).
(3)根据溶液中物料守恒、质子守恒进行计算.
②根据CH3COONa溶液呈碱性可知,要使混合后呈中性,必须醋酸过量;根据电荷守恒来分析;
(2)①酸或碱抑制水电离,如果酸中c(H+)等于碱中c(OH-),则酸或碱抑制水电离程度相等;
②常温下,pH=3的醋酸浓度大于pH=11的NaOH浓度,如果a=b,二者反应时醋酸有剩余,溶液呈酸性,再结合电荷守恒判断c(CH3COO-)、c(Na+).
(3)根据溶液中物料守恒、质子守恒进行计算.
解答:
解:(1)①当a=b时,两者恰好完全中和,得CH3COONa溶液,呈碱性,故有:c(H+)<c(OH-),根据电荷守恒可知:c(CH3COO-)<c(Na+),故离子浓度的关系为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+);故答案为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+);
②根据CH3COONa溶液呈碱性可知,要使混合后呈中性,必须醋酸过量,即a>b;既然溶液呈中性,则有:c(OH-)=c(H+),根据电荷守恒可知:c(Na+)=c(CH3COO-),故答案为:>;=;
(2)①酸或碱抑制水电离,如果酸中c(H+)等于碱中c(OH-),则酸或碱抑制水电离程度相等,常温下,pH=3 CH3COOH溶液中c(H+)等于pH=11的NaOH中c(OH-)为0.01mol/L,所以二者抑制水电离程度相等,则两溶液由水电离出的H+浓度之比为1:1,故答案为:1:1;
②常温下,pH=3的醋酸浓度大于pH=11的NaOH浓度,如果a=b,二者反应时醋酸有剩余,溶液呈酸性,醋酸的电离程度很小,所以溶液中浓度最大的是CH3COOH,溶液呈酸性,则c(OH-)<c(H+),根据电荷守恒得c(CH3COO-)>c(Na+),溶液中CH3COO-抑制CH3COOH电离,所以反应后溶液中粒子(除水分子外)浓度从大到小的顺序是c(CH3COOH)>c(CH3COO-)>c(Na+)>c(H+)>c(OH-),
故答案为:c(CH3COOH)>c(CH3COO-)>c(Na+)>c(H+)>c(OH-).
(3)根据物料守恒可得:c(A-)+c(HA)=c(Na+)=0.05mol/L;
根据质子守恒:c(OH-)=c(HA)+c(H+),则c(OH-)-c(HA)=c(H+)=1×10-10mol/L,
故答案为:0.05;1×10-10.
②根据CH3COONa溶液呈碱性可知,要使混合后呈中性,必须醋酸过量,即a>b;既然溶液呈中性,则有:c(OH-)=c(H+),根据电荷守恒可知:c(Na+)=c(CH3COO-),故答案为:>;=;
(2)①酸或碱抑制水电离,如果酸中c(H+)等于碱中c(OH-),则酸或碱抑制水电离程度相等,常温下,pH=3 CH3COOH溶液中c(H+)等于pH=11的NaOH中c(OH-)为0.01mol/L,所以二者抑制水电离程度相等,则两溶液由水电离出的H+浓度之比为1:1,故答案为:1:1;
②常温下,pH=3的醋酸浓度大于pH=11的NaOH浓度,如果a=b,二者反应时醋酸有剩余,溶液呈酸性,醋酸的电离程度很小,所以溶液中浓度最大的是CH3COOH,溶液呈酸性,则c(OH-)<c(H+),根据电荷守恒得c(CH3COO-)>c(Na+),溶液中CH3COO-抑制CH3COOH电离,所以反应后溶液中粒子(除水分子外)浓度从大到小的顺序是c(CH3COOH)>c(CH3COO-)>c(Na+)>c(H+)>c(OH-),
故答案为:c(CH3COOH)>c(CH3COO-)>c(Na+)>c(H+)>c(OH-).
(3)根据物料守恒可得:c(A-)+c(HA)=c(Na+)=0.05mol/L;
根据质子守恒:c(OH-)=c(HA)+c(H+),则c(OH-)-c(HA)=c(H+)=1×10-10mol/L,
故答案为:0.05;1×10-10.
点评:本题考查了盐溶液呈酸碱性的原因、溶液酸碱性的判断、离子浓度的计算等知识,难度中等,注意掌握酸碱混合的定性判断方法,明确盐的水解原理,能够根据电荷守恒、物料守恒等计算溶液中离子浓度.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
单质X能从含有Y的盐溶液中置换出单质Y,由此可知( )
| A、当Y是金属时,X可能是金属,也可能是非金属 |
| B、当X、Y都是非金属时,Y的非金属性一定比X强 |
| C、当X、Y都是金属时,Y的金属性一定比X强 |
| D、当Y是非金属时,X可能是金属也可能是非金属 |
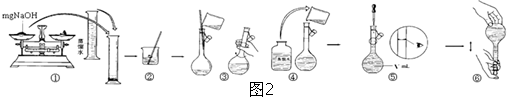
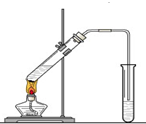 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题: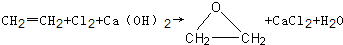

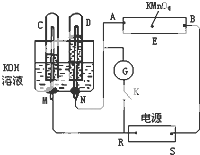 如图所示,E为沾有Na2SO4溶液的滤纸,并加入几滴酚酞.A,B分别为Pt片,压在滤纸两端,R、S为电池的电极.M、N是用多微孔的Ni的电极材料,它在碱溶液中可以视为惰性电极.G为电流计,K为开关.C、D和电解池中都充满浓KOH溶液.若在滤纸中央点上一滴紫色的KMnO4溶液,K打开,接通电源一段时间后,C、D中有气体产生,气体体积如图所示.
如图所示,E为沾有Na2SO4溶液的滤纸,并加入几滴酚酞.A,B分别为Pt片,压在滤纸两端,R、S为电池的电极.M、N是用多微孔的Ni的电极材料,它在碱溶液中可以视为惰性电极.G为电流计,K为开关.C、D和电解池中都充满浓KOH溶液.若在滤纸中央点上一滴紫色的KMnO4溶液,K打开,接通电源一段时间后,C、D中有气体产生,气体体积如图所示.