题目内容
8.将铜片、银片用导线相连插入AgNO3溶液中构成一个原电池.以下有关该原电池的叙述正确的是( )①在外电路中,电流由铜电极流向银电极
②正极反应为:Ag++e-=Ag
③溶液中Ag+向负极定向移动
④将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同.
| A. | ①② | B. | ②③ | C. | ②④ | D. | ③④ |
分析 该原电池为银铜原电池,铜比阴活泼,故铜为负极,银为正极,负极反应式为:Cu-2e-=Cu2+,正极:Ag++e-=Ag,根据原电池的工作原理得出正确结论.
解答 解:①在外电路中,电子由负极流向正极,故电流由正极流向负极,故电流由银电极流向铜电极,故①错误;
②银为正极,电极反应式为:Ag++e-=Ag,故②正确;
③溶液中阳离子向正极移动,则Ag+向正极定向移动,故③错误;
④该原电池的电极反应式为:负极:Cu-2e-=Cu2+正极:Ag++e-=Ag,故总反应为Cu+2Ag+=Cu2++2Ag.铜片与硝酸银反应的离子方程式为Cu+2Ag+=Cu2++2Ag,与原电池的总反应相同,故④正确.
故选C.
点评 本题考察了原电池和电解池的工作原理及电极反应式和总反应方程式的书写,明确电极、电极反应即可解答,题目难度不大.

练习册系列答案
 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案
相关题目
18.阿伏加德罗常数的符号是NA,下列叙述中正确的是( )
| A. | 100ml 18.4mol/L的硫酸溶液中含氢离子的数目为3.68NA | |
| B. | 若x g 中含NA个分子,则2x g中含2NA个分子 | |
| C. | 常温常压下,92gNO2和N2O4的混合气体含有的原子数为6NA | |
| D. | 11g铵根离子[NH2T2]+中含中子数为4.5NA |
19.乙醇、乙二醇、丙三醇中分别加入足量金属钠,产生等体积的氢气(相同条件下),则上述三种醇的物质的量之比是( )
| A. | 3:2:1 | B. | 1:1:1 | C. | 1:2:3 | D. | 6:3:2 |
13. 如图所示,在U型管(惰性电极)装入含有紫色石蕊的Na2SO4溶液,通直流电,一段时间后U型内会形成一个倒立的三色“彩虹”,从左到右颜色的次序是( )
如图所示,在U型管(惰性电极)装入含有紫色石蕊的Na2SO4溶液,通直流电,一段时间后U型内会形成一个倒立的三色“彩虹”,从左到右颜色的次序是( )
 如图所示,在U型管(惰性电极)装入含有紫色石蕊的Na2SO4溶液,通直流电,一段时间后U型内会形成一个倒立的三色“彩虹”,从左到右颜色的次序是( )
如图所示,在U型管(惰性电极)装入含有紫色石蕊的Na2SO4溶液,通直流电,一段时间后U型内会形成一个倒立的三色“彩虹”,从左到右颜色的次序是( )| A. | 紫、红、蓝 | B. | 红、蓝、紫 | C. | 红、紫、蓝 | D. | 蓝、紫、红 |
17.下列描述中不正确的是( )
| A. | CS2为直线形的非极性分子 | |
| B. | ClO3-的空间构型为平面三角形 | |
| C. | SF6中有6对完全相同的成键电子对 | |
| D. | SiF4和SO32-的中心原子均为sp3杂化 |
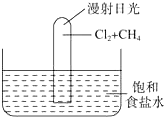 如图所示实验,试推测可能观察到的现象是:
如图所示实验,试推测可能观察到的现象是: