题目内容
过氧化钠是一种淡黄色固体,常用作制氧剂,供人类呼吸之用,某学生为了验证这一实验,以足量的大理石、足量的盐酸和3.9克过氧化钠样品为原料,制取O2,设计出如图4实验装置:
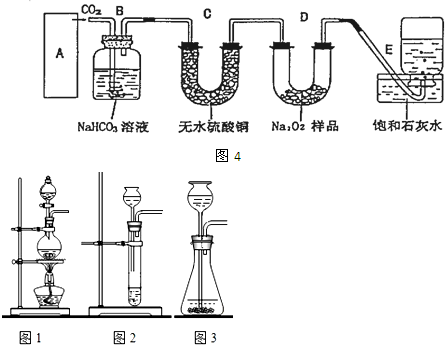
(1)A中制取CO2的装置,应从如图1、2、3中选哪个图: B装置的作用是 ,C装置内可能出现的现象是 .
为了检验E中收集到的气体,在取出集气瓶后,用 的木条伸入集气瓶内,木条会出现 .
(2)若E中的石灰水出现出现轻微白色浑浊,请说明原因: .
(3)若D中的3.9g过氧化钠样品接近反应完毕时,你预测E装置内有何现象? .
(4)反应完毕时,若测得E中的集气瓶收集到的气体为500mL,当装置的气密性良好的情况下,实际收集到的氧气体积比理论计算值 (答大或小),相差约 mL(取整数值,所用数据均在标准状况下测定),这是由于 .
(5)写出D装置中反应方程式 .

(1)A中制取CO2的装置,应从如图1、2、3中选哪个图:
为了检验E中收集到的气体,在取出集气瓶后,用
(2)若E中的石灰水出现出现轻微白色浑浊,请说明原因:
(3)若D中的3.9g过氧化钠样品接近反应完毕时,你预测E装置内有何现象?
(4)反应完毕时,若测得E中的集气瓶收集到的气体为500mL,当装置的气密性良好的情况下,实际收集到的氧气体积比理论计算值
(5)写出D装置中反应方程式
考点:常见气体制备原理及装置选择
专题:实验题
分析:(1)实验室用碳酸钙和稀盐酸反应制备二氧化碳,反应无需加热,且反应需要较多二氧化碳,应用图3装置制备;实验中要依次进行除杂、干燥收集等操作;
(2)二氧化碳和澄清石灰水反应生成碳酸钙白色沉淀;
(3)如过氧化钠完全反应,则E中产生大量沉淀,E中液面不在变化;
(4)根据过氧化钠的质量可以生成氧气的体积,理论生成气体的体积-实际氧气的体积=差值;
(5)D装置中过氧化钠与二氧化碳反应生成碳酸钠和氧气.
(2)二氧化碳和澄清石灰水反应生成碳酸钙白色沉淀;
(3)如过氧化钠完全反应,则E中产生大量沉淀,E中液面不在变化;
(4)根据过氧化钠的质量可以生成氧气的体积,理论生成气体的体积-实际氧气的体积=差值;
(5)D装置中过氧化钠与二氧化碳反应生成碳酸钠和氧气.
解答:
解:(1)该反应的药品是固体和液体,且不需加热,所以所需装置为固液混合不加热型,所以排除图1;图2中只能制取少量二氧化碳而不能制取大量二氧化碳,所以排除图2,故选图3;
大理石和盐酸的反应是放热反应,盐酸具有挥发性,所以制取的二氧化碳中含有氯化氢气体、水蒸气,氯化氢和碳酸氢钠能反应生成二氧化碳,所以B装置的作用是吸收A装置中产生的盐酸酸雾,除去HCl气体;
二氧化碳和碳酸氢钠不反应,水蒸气能使无水硫酸铜由白色变蓝色,所以C装置内可能出现的现象是白色固体变蓝色;
过氧化钠和二氧化碳反应生成氧气,氧气能使带火星的木条复燃,检验时,可用带火星的木条放在管口,木条复燃说明收集到的气体为氧气,
故答案为:图3;吸收A装置中产生的盐酸酸雾;变蓝色;带火星的,复燃;
(2)二氧化碳能使澄清的石灰水变浑浊,若E中石灰水出现轻微白色浑浊,说明未反应的二氧化碳与石灰水反应所致,
故答案为:未反应的二氧化碳与石灰水反应所致;
(3)若D中的3.9g过氧化钠样品接近反应完毕时,所以E中可能会因二氧化碳与石灰水反应而生成较多沉淀,而且E气体的量基本不,则E中液面基本不变;
故答案为:E中石灰水的白色浑浊明显增加,瓶内液面的下降接近停止;
(4)3.9g过氧化钠完全反应生成氧气的体积为v.
2Na2O2----O2
2mol 22.4L
V
V=0.56L=560mL>500mL,所以实际收集到的氧气体积比理论计算值小;
560mL-500mL=60mL;
原因是因样品中含有不与CO2反应生成气体的杂质,导致生成的氧气的体积偏小;
故答案为:小;60;因样品中含有不与CO2反应生成气体的杂质;
(5)D装置中过氧化钠与二氧化碳反应生成碳酸钠和氧气,其反应方程式为:2Na2O2+2CO2═2Na2CO3+O2;
故答案为:2Na2O2+2CO2═2Na2CO3+O2.
大理石和盐酸的反应是放热反应,盐酸具有挥发性,所以制取的二氧化碳中含有氯化氢气体、水蒸气,氯化氢和碳酸氢钠能反应生成二氧化碳,所以B装置的作用是吸收A装置中产生的盐酸酸雾,除去HCl气体;
二氧化碳和碳酸氢钠不反应,水蒸气能使无水硫酸铜由白色变蓝色,所以C装置内可能出现的现象是白色固体变蓝色;
过氧化钠和二氧化碳反应生成氧气,氧气能使带火星的木条复燃,检验时,可用带火星的木条放在管口,木条复燃说明收集到的气体为氧气,
故答案为:图3;吸收A装置中产生的盐酸酸雾;变蓝色;带火星的,复燃;
(2)二氧化碳能使澄清的石灰水变浑浊,若E中石灰水出现轻微白色浑浊,说明未反应的二氧化碳与石灰水反应所致,
故答案为:未反应的二氧化碳与石灰水反应所致;
(3)若D中的3.9g过氧化钠样品接近反应完毕时,所以E中可能会因二氧化碳与石灰水反应而生成较多沉淀,而且E气体的量基本不,则E中液面基本不变;
故答案为:E中石灰水的白色浑浊明显增加,瓶内液面的下降接近停止;
(4)3.9g过氧化钠完全反应生成氧气的体积为v.
2Na2O2----O2
2mol 22.4L
| 3.9g |
| 78g/mol |
V=0.56L=560mL>500mL,所以实际收集到的氧气体积比理论计算值小;
560mL-500mL=60mL;
原因是因样品中含有不与CO2反应生成气体的杂质,导致生成的氧气的体积偏小;
故答案为:小;60;因样品中含有不与CO2反应生成气体的杂质;
(5)D装置中过氧化钠与二氧化碳反应生成碳酸钠和氧气,其反应方程式为:2Na2O2+2CO2═2Na2CO3+O2;
故答案为:2Na2O2+2CO2═2Na2CO3+O2.
点评:本题以钠的化合物为载体综合考查学生的分析能力和实验能力,注意把握实验的原理和注意事项,结合物质的性质把握实验,难度中等.

练习册系列答案
相关题目
实验是研究化学的基础,下图中所示的实验方法、装置或操作完全正确的是( )
A、 除去氯气中的氯化氢 |
B、 称量 |
C、 用石灰石和稀盐酸制取CO2 |
D、 稀释 |

 在一次化学研究性学习实验中,某研究小组学生,研究分析某两瓶无标签的试剂,只知道一瓶是固体,另一瓶是液体,取少量两种试剂在试管中混合,立即产生一种无色无味的气体.现请你对此气体开展一系列探究,并完成下列实验报告.
在一次化学研究性学习实验中,某研究小组学生,研究分析某两瓶无标签的试剂,只知道一瓶是固体,另一瓶是液体,取少量两种试剂在试管中混合,立即产生一种无色无味的气体.现请你对此气体开展一系列探究,并完成下列实验报告.