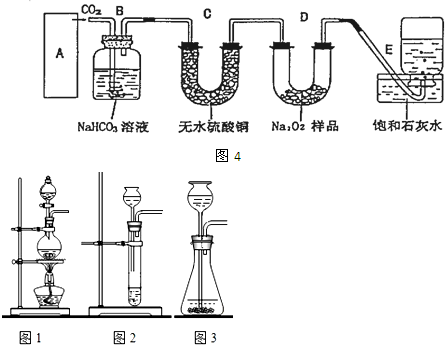
题目内容
实验是研究化学的基础,下图中所示的实验方法、装置或操作完全正确的是( )
A、 除去氯气中的氯化氢 |
B、 称量 |
C、 用石灰石和稀盐酸制取CO2 |
D、 稀释 |
考点:化学实验方案的评价,物质的分离、提纯和除杂,常见气体制备原理及装置选择
专题:实验评价题
分析:A.根据洗气装置的特点分析,洗气装置中长导管进气,短导管出气;
B.烧碱有强腐蚀性;
C.打开导管时长颈漏斗中的液体流出;
D.量筒只能用来量取液体,不能用来溶解固体或稀释液体.
B.烧碱有强腐蚀性;
C.打开导管时长颈漏斗中的液体流出;
D.量筒只能用来量取液体,不能用来溶解固体或稀释液体.
解答:
解:A.洗气装置中长导管进气,短导管出气,所以该装置不符合洗气装置特点,故A错误;
B.用天平称量药品时,遵循“左物右码“的原则,且强腐蚀性的氢氧化钠应放在烧杯中称量,故B错误;
C.打开导管时长颈漏斗中的液体流出,浸没石灰石,发生反应,关闭时,气压增大,液面和石灰石分离,反应停止,故C正确;
D.量筒只能用来量取液体,不能用来溶解固体或稀释液体,且浓硫酸的稀释时,是浓硫酸倒入水中不是水倒入浓硫酸中,故D错误.
故选C.
B.用天平称量药品时,遵循“左物右码“的原则,且强腐蚀性的氢氧化钠应放在烧杯中称量,故B错误;
C.打开导管时长颈漏斗中的液体流出,浸没石灰石,发生反应,关闭时,气压增大,液面和石灰石分离,反应停止,故C正确;
D.量筒只能用来量取液体,不能用来溶解固体或稀释液体,且浓硫酸的稀释时,是浓硫酸倒入水中不是水倒入浓硫酸中,故D错误.
故选C.
点评:本题考查了实验装置或操作的基本知识,难度不大,注意浓硫酸的稀释中应该是:浓硫酸倒入水中不是水倒入浓硫酸中,且不断搅拌防止温度过高.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列粒子中,与H3O+所含质子数、电子数相等,且化学键类型相同的粒子是( )
| A、Na+ |
| B、NH4+ |
| C、Ne |
| D、NH3 |
已知:Fe2+结合S2-的能力大于结合OH-的能力,而Al3+则正好相反,I2的氧化性比S强.在Fe2(SO4)3和AlCl3的混合溶液中,先加入过量的KI溶液,再加入足量的Na2S溶液,所得沉淀是( )
| A、Fe2S3和 Al(OH)3 |
| B、Fe(OH)3和Al(OH)3 |
| C、FeS、Al(OH)3 和S |
| D、Al2S3、FeS和S |
下列反应属于氧化还原反应的是( )
A、2KMnO4
| ||||
| B、H2SO4+BaCl2=BaSO4↓+2HCl | ||||
C、Cu2(OH)2CO3
| ||||
| D、SO3+H2O=H2SO4 |
下列物质中不属于羧酸类有机物的是( )
A、 (乙二酸) (乙二酸) |
B、 -COOH (苯甲酸) -COOH (苯甲酸) |
| C、CH2CH-COOH(丙烯酸) |
D、 (石炭酸) (石炭酸) |
下面是有关弱酸的电离平衡常数.
结合数据,分析下列有关说法,其中错误的是( )
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
| A、1 mol?L-1的溶液中,pH(NaCN)>pH(Na2CO3)>pH(CH3COONa) |
| B、升高温度时,HCN溶液中HCN的电离平衡正向移动,c(H+)增大,电离平衡常数增大 |
| C、向稀醋酸中加入相同浓度的HCN溶液,醋酸的电离平衡正向移动 |
| D、饱和H2CO3溶液中c(H+)与 c(CO32-)的比值大于2 |
下列表达不正确的是( )
| A、反应2NO2═O2+2NO;△H=+116.2kJ/mol 任何情况非自发 |
| B、Na2CO3溶液中:c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3) |
| C、表示碳燃烧热的热化学方程式为 C(s)+O2(g)=CO2(g);△H=-393.5kJ/mol |
| D、等物质的量的KHCO3和Ba(OH)2的溶液混合:HCO3-+Ba2++OH-=BaCO3↓+H2O |