题目内容
14.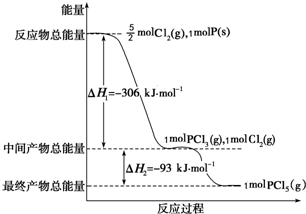 红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).根据如图回答下列问题:
(1)P和Cl2反应生成PCl3的热化学方程式是P(s)+$\frac{3}{2}$Cl2(g)═PCl3(g)△H=-306kJ•mol-1.
(2)PCl5分解成PCl3和Cl2的热化学方程式是PCl5(g)=PCl3(g)+Cl2(g)△H=+93 kJ/mol.上述分解反应是一个可逆反应.若反应压强由P1升高到P2,则平衡时PCl5的分解率,将变小(填“变大”、“变小”或“不变”).
(3)工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5.原因是两步反应均为放热反应,降低温度有利于提高产率,防止产物分解.
(4)PCl5与足量水充分反应,最终生成两种酸,其化学方程式是PCl5+4H2O═H3PO4+5HCl.
分析 (1)由图可知P(s)+32Cl2(g)→PCl3(g),反应物的总能量大于生成物的总能量,该反应是放热反应,反应热为△H=-306 kJ/mol;
(2)PCl5(g)=PCl3(g)+Cl2(g)是吸热反应,△H=+93 kJ/mol,增大压强,平衡逆向移动,PCl5的分解率变小;
(3)Cl2(g)+PCl3(g)=PCl5(g),是放热反应,降温平衡向放热反应方向移动,降温有利于PCl5(g)的生成;
(4)PCl5能与水相反相成,发生非氧化还原反应,生成盐酸和磷酸.
解答 解:(1)根据图示P(s)+32Cl2(g)→PCl3(g),反应物的总能量大于生成物的总能量,该反应是放热反应,反应热为△H=-306 kJ/mol,热化学方程式为:P(s)+32Cl2(g)═PCl3(g)△H=-306 kJ/mol,
故答案为:P(s)+$\frac{3}{2}$Cl2(g)═PCl3(g)△H=-306kJ•mol-1;
(2)△H=生成物总能量-反应物总能量,Cl2(g)+PCl3(g)=PCl5(g),中间产物的总能量大于最终产物的总能量,该反应是放热反应,所以 PCl5(g)=PCl3(g)+Cl2(g)是吸热反应;热化学方程式:PCl5(g)=PCl3(g)+Cl2(g)△H=+93 kJ/mol,增大压强,平衡逆向移动,PCl5的分解率变小,
故答案为:PCl5(g)=PCl3(g)+Cl2(g)△H=+93 kJ/mol;变小;
(3)Cl2(g)+PCl3(g)=PCl5(g),是放热反应,降温平衡向放热反应方向移动,降温有利于PCl5(g)的生成,
故答案为:两步反应均为放热反应,降低温度有利于提高产率,防止产物分解;
(4)PCl5能与水相反相成,发生非氧化还原反应,生成盐酸和磷酸,反应方程式为:PCl5+4H2O═H3PO4+5HCl,故答案为:PCl5+4H2O═H3PO4+5HCl.
点评 本题考查较为综合,多角度考查反应热和化学方程式的书写、外界条件对化学平衡移动的影响及反应热的计算等知识,为高考常见题型,侧重于学生的分析、计算能力的考查,题目难度中等.

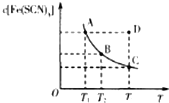 已知:FeCl3(aq)+3KSCN(aq)?3KCl(aq)+Fe(SCN)3(aq),平衡时Fe(SCN)3的物质的量浓度与温度T的关系如图所示,则下列说法正确的是( )
已知:FeCl3(aq)+3KSCN(aq)?3KCl(aq)+Fe(SCN)3(aq),平衡时Fe(SCN)3的物质的量浓度与温度T的关系如图所示,则下列说法正确的是( )| A. | A点与B点相比,A点的血红色沉淀更多 | |
| B. | 加入KCl固体可以使溶液由D点变到C点 | |
| C. | 反应处于D点时,一定有V(正)<V(逆) | |
| D. | 若T1、T2温度下的平衡常数分别为K1、K2,K1<K2 |
| A. | 在稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol,若将含0.6mol H2SO4的稀硫酸与含1mol NaOH的稀溶液混合,放出的热量等于57.3 kJ | |
| B. | 已知正丁烷(g)→异丁烷(g)△H<0,则正丁烷比异丁烷稳定 | |
| C. | 2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1,则H2的燃烧热为571.6 kJ•mol-1 | |
| D. | 已知2C(s)+2O2(g)═2CO2(g)△H1;2C(s)+O2(g)═2CO(g)△H2,则△H1>△H2 |

| A. | 2:7或5:4 | B. | 2:1或5:4 | C. | 4:5或7:2 | D. | 2:1或7:2 |
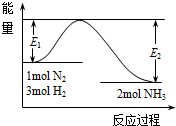 氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法.
氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法. 二氧化硫和氮的氧化物是常用的工业原料,但也是大气的主要污染物.综合治理其污染是环境化学当前的重要研究内容之一.
二氧化硫和氮的氧化物是常用的工业原料,但也是大气的主要污染物.综合治理其污染是环境化学当前的重要研究内容之一.