题目内容
亚硝酸钠(NaNO2)是一种外观与食盐相似的食品添加剂.某化学兴趣小组进行如下实验.
【实验I】
用如下装置(已省略夹持装置)制NaNO2.
已知:2NO+Na2O2═2NaNO2;2NO2+Na2O2═2NaNO3.
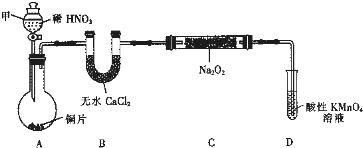
(1)仪器甲的名称是 .装置B的作用是 .
(2)装置D可将剩余的NO氧化成NO3-,发生反应的离子方程式为 .
(3)使用气密性良好的上述装置进行实验,NaNO2的纯度较低.为提高NaNO2纯度须对上述实验装置或药品进行改进,其改进措施是 .
【实验Ⅱ】
利用目视比色法(比较溶液颜色深浅以测定物质浓度)测定泡菜样品中NaNO2的含量.
步骤i:在5个有编号的试管中分别加入不同量的NaNO2溶液,各加入1mL的M溶液(M遇NaNO2呈紫红色,NaNO2浓度越大颜色越深),再加蒸馏水至总体积均为l0mL并振荡,制成标准色阶.
步骤ii:1kg泡菜样品
滤液
滤液
待测液X
步骤ⅲ:取5mL待测液X,加入1mL M溶液,加蒸馏水至10mL振荡,与标准色阶比较.
(4)步骤ii获取待测液X的过程中,加入明矾的目的是 .
(5)步骤iii比较结果与④号色阶颜色相同,此泡菜样品中NaNO2的含量为 mg?kg-1
(6)用目视比色法证明泡菜中加入维生素C可以降低NaNO2的含量.设计并完成下列实验报告.
【实验I】
用如下装置(已省略夹持装置)制NaNO2.
已知:2NO+Na2O2═2NaNO2;2NO2+Na2O2═2NaNO3.

(1)仪器甲的名称是
(2)装置D可将剩余的NO氧化成NO3-,发生反应的离子方程式为
(3)使用气密性良好的上述装置进行实验,NaNO2的纯度较低.为提高NaNO2纯度须对上述实验装置或药品进行改进,其改进措施是
【实验Ⅱ】
利用目视比色法(比较溶液颜色深浅以测定物质浓度)测定泡菜样品中NaNO2的含量.
步骤i:在5个有编号的试管中分别加入不同量的NaNO2溶液,各加入1mL的M溶液(M遇NaNO2呈紫红色,NaNO2浓度越大颜色越深),再加蒸馏水至总体积均为l0mL并振荡,制成标准色阶.
| 试管编号 | ① | ② | ③ | ④ | ⑤ |
| NaNO2含量/mg?L-1 | 0 | 20 | 40 | 60 | 80 |
| 粉碎浸泡 |
| 过滤 |
| 明矾 |
| 静置过滤 |
| 稀释至1L |
步骤ⅲ:取5mL待测液X,加入1mL M溶液,加蒸馏水至10mL振荡,与标准色阶比较.
(4)步骤ii获取待测液X的过程中,加入明矾的目的是
(5)步骤iii比较结果与④号色阶颜色相同,此泡菜样品中NaNO2的含量为
(6)用目视比色法证明泡菜中加入维生素C可以降低NaNO2的含量.设计并完成下列实验报告.
| 实验方案 | 实验现象 | 实验结论 |
| 维生素C可以降低泡菜中NaNO2的含量 |
考点:性质实验方案的设计
专题:实验设计题,元素及其化合物
分析:(1)仪器甲的名称是分液漏斗;NO中混有水蒸气,水能与过氧化钠反应;
(2)高锰酸钾具有氧化性,能将一氧化氮氧化,根据电子守恒配平方程式即可;
(3)硝酸具有挥发性,会干扰实验结果,据此回答分析;
(4)明矾溶于水电离出的铝离子水解生成氢氧化铝胶体,具有吸附性,吸附悬浮物使滤液澄清;
(5)溶液体积加倍,浓度变为原来的一半,④号色阶对应泡菜样品中NaNO2的含量为60mg?kg-1,则此泡菜样品中NaNO2的含量为 120mg?kg-1;
(6)根据维生素C的作用结合(5)的计算结果来回答.
(2)高锰酸钾具有氧化性,能将一氧化氮氧化,根据电子守恒配平方程式即可;
(3)硝酸具有挥发性,会干扰实验结果,据此回答分析;
(4)明矾溶于水电离出的铝离子水解生成氢氧化铝胶体,具有吸附性,吸附悬浮物使滤液澄清;
(5)溶液体积加倍,浓度变为原来的一半,④号色阶对应泡菜样品中NaNO2的含量为60mg?kg-1,则此泡菜样品中NaNO2的含量为 120mg?kg-1;
(6)根据维生素C的作用结合(5)的计算结果来回答.
解答:
解:(1)仪器甲的名称是分液漏斗;NO中混有水蒸气,水能与过氧化钠反应,所以装置B的作用是干燥NO,故答案为:分液漏斗,干燥NO;
(2)高锰酸钾具有氧化性,能将一氧化氮氧化,反应的实质是:5NO+3MnO4-+4H+=5NO3-+3Mn2++2H2O,故答案为:5NO+3MnO4-+4H+=5NO3-+3Mn2++2H2O;
(3)由于获得一氧化氮所用的硝酸具有挥发性,这样会干扰实验结果,可以在A、B之间增加装有水的洗气瓶,减小实验误差,故答案为:在A、B之间增加装有水的洗气瓶;
(4)明矾溶于水电离出的铝离子水解生成氢氧化铝胶体,具有吸附性,吸附悬浮物使滤液澄清,故答案为:吸附悬浮物使滤液澄清;
(5)步骤ⅲ:取5mL待测液X,加入1mL M溶液,加蒸馏水至10mL振荡,浓度变为原来的一半,④号色阶对应泡菜样品中NaNO2的含量为60mg?kg-1,则此泡菜样品中NaNO2的含量为 120mg?kg-1,故答案为:120;
(6)要和前面的实验方案做对比试验,同样可以是先取5mL甲待测液,然后加入维生素C,并加入1 mLM溶液,最后加入蒸馏水至10mL,若紫红色比④色阶浅,说明亚硝酸钠的含量低,则可以证明维生素C可以有效降低NaNO2的含量.
故答案为:实验方案:取5mL待测液X,加入维生素C,振荡,再加入1 mL M溶液,加入蒸馏水至10mL,与④号色阶比较;实验现象:紫红色比④色阶浅.
(2)高锰酸钾具有氧化性,能将一氧化氮氧化,反应的实质是:5NO+3MnO4-+4H+=5NO3-+3Mn2++2H2O,故答案为:5NO+3MnO4-+4H+=5NO3-+3Mn2++2H2O;
(3)由于获得一氧化氮所用的硝酸具有挥发性,这样会干扰实验结果,可以在A、B之间增加装有水的洗气瓶,减小实验误差,故答案为:在A、B之间增加装有水的洗气瓶;
(4)明矾溶于水电离出的铝离子水解生成氢氧化铝胶体,具有吸附性,吸附悬浮物使滤液澄清,故答案为:吸附悬浮物使滤液澄清;
(5)步骤ⅲ:取5mL待测液X,加入1mL M溶液,加蒸馏水至10mL振荡,浓度变为原来的一半,④号色阶对应泡菜样品中NaNO2的含量为60mg?kg-1,则此泡菜样品中NaNO2的含量为 120mg?kg-1,故答案为:120;
(6)要和前面的实验方案做对比试验,同样可以是先取5mL甲待测液,然后加入维生素C,并加入1 mLM溶液,最后加入蒸馏水至10mL,若紫红色比④色阶浅,说明亚硝酸钠的含量低,则可以证明维生素C可以有效降低NaNO2的含量.
故答案为:实验方案:取5mL待测液X,加入维生素C,振荡,再加入1 mL M溶液,加入蒸馏水至10mL,与④号色阶比较;实验现象:紫红色比④色阶浅.
点评:本题是一道实验方案的设计和探究题,考查学生分析和解决问题的能力,综合性强,难度大.

练习册系列答案
 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案
相关题目
贴有下列危险品标志的药品起火时,不能用水灭火的是( )
A、 剧毒品 |
B、 遇湿易燃物品 |
C、 腐蚀品 |
D、 有害品(远离食品) |
某气态链烃能使溴水褪色,经测定该烃存在支链,并且0.1mol该烃充分燃烧可以生成7.2g水,请据此回答下列问题.
(1)通过计算确定该烃具有的分子式和结构简式.
(2)请对(1)中所确定的烃进行系统命名.
(1)通过计算确定该烃具有的分子式和结构简式.
(2)请对(1)中所确定的烃进行系统命名.
恒温下,容积均为2L的密闭容器M、N中,分别有以下列两种起始投料建立的可逆反应3A(g)+2B(g)?2C(g)+xD(s)的化学平衡状态,相关数据如下:M:3mol A、2mol B;2min达平衡,生成D 1.2mol,测得从反应开始到平衡C的速率为0.3mol?(L?min)-1.N:2mol C、y mol D;达平衡时c(A)=0.6mol?L-1.下列推断的结论中不正确的是( )
| A、x=2 |
| B、平衡时M中c(A)<0.6 mol/L |
| C、y>0.8 |
| D、M、N达到平衡时容器中各物质浓度相等 |
 ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题: