题目内容
A、B、C、D是四种短周期元素,E是过渡元素.A、B、C同周期,C、D同主族,A的原子结构示意图为: ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:
(1)写出下列元素的符号:A B C D
(2)用化学式表示上述五种元素中最高价氧化物对应水化物酸性最强的是 .
(3)用元素符号表示D所在周期第一电离能最大的元素是 ,电负性最大的元素是 .
(4)D的氢化物比C的氢化物的沸点 (填“高“或“低“),原因
(5)画出D的核外电子排布图 ,这样排布遵循了 原理和 规则.
(6)用电子式表示D的氢化物的形成过程: .
 ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:(1)写出下列元素的符号:A
(2)用化学式表示上述五种元素中最高价氧化物对应水化物酸性最强的是
(3)用元素符号表示D所在周期第一电离能最大的元素是
(4)D的氢化物比C的氢化物的沸点
(5)画出D的核外电子排布图
(6)用电子式表示D的氢化物的形成过程:
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A、B、C、D是四种短周期元素,由A的原子结构示意图可知,x=2,A的原子序数为14,故A为Si元素;A、B、C同周期,B是同周期第一电离能最小的元素,故B为Na元素,C的最外层有三个成单电子,外围电子排布式为3s23p3,故C为P元素;C、D同主族,故D为N元素;E是过渡元素,E的外围电子排布式为3d64s2,E的核外电子排布式为1s22s22p63s23p63d64s2,则E为Fe元素,据此解答.
解答:
解:A、B、C、D是四种短周期元素,由A的原子结构示意图可知,x=2,A的原子序数为14,故A为Si元素;A、B、C同周期,B是同周期第一电离能最小的元素,故B为Na元素,C的最外层有三个成单电子,外围电子排布式为3s23p3,故C为P元素;C、D同主族,故D为N元素;E是过渡元素,E的外围电子排布式为3d64s2,E的核外电子排布式为1s22s22p63s23p63d64s2,则E为Fe元素,
(1)由上述分析可知,A为Si,B为Na,C为P,D为N,故答案为:Si;Na;P;N;
(2)非金属越强最高价氧化物对应水化物酸性越强,非金属性N>P>Si,酸性最强的是HNO3,故答案为:HNO3;
(3)同周期自左而右,第一电离能增大,所以第一电离能最大的元素是Ne,周期自左而右,电负性增大,故电负性最大的元素是F,
故答案为:Ne;F;
(4)D的氢化物为NH3,氨气分子之间含有氢键,沸点比PH3高,故答案为:高;氨气分子之间含有氢键;
(5)D为氮元素,原子核外电子排布式为1s22s22p3,核外电子排布图 ,符合泡利原理与洪特规则,
,符合泡利原理与洪特规则,
故答案为: ;泡利;洪特;
;泡利;洪特;
(6)用电子式表示NH3的形成过程为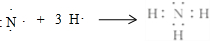 ,故答案为:
,故答案为: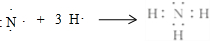 .
.
(1)由上述分析可知,A为Si,B为Na,C为P,D为N,故答案为:Si;Na;P;N;
(2)非金属越强最高价氧化物对应水化物酸性越强,非金属性N>P>Si,酸性最强的是HNO3,故答案为:HNO3;
(3)同周期自左而右,第一电离能增大,所以第一电离能最大的元素是Ne,周期自左而右,电负性增大,故电负性最大的元素是F,
故答案为:Ne;F;
(4)D的氢化物为NH3,氨气分子之间含有氢键,沸点比PH3高,故答案为:高;氨气分子之间含有氢键;
(5)D为氮元素,原子核外电子排布式为1s22s22p3,核外电子排布图
 ,符合泡利原理与洪特规则,
,符合泡利原理与洪特规则,故答案为:
 ;泡利;洪特;
;泡利;洪特;(6)用电子式表示NH3的形成过程为
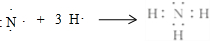 ,故答案为:
,故答案为: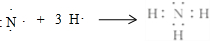 .
.
点评:本题考查结构性质位置关系应用,涉及元素周期律、核外电子排布规律、电子式等,难度不大,推断元素是解题的关键,注意熟练掌握元素周期律与物质性质的递变规律.

练习册系列答案
相关题目
以下关于离子方程式书写正确的是( )
| A、碳酸氢钙溶液中滴加少量的氢氧化钠溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O | ||||
| B、金属铝与稀硝酸反应:2Al+6H+=2Al3++3H2↑ | ||||
C、向NH4HCO3溶液中加过量NaOH溶液并加热:NH4++OH-
| ||||
| D、碳酸氢铵溶液中加入过量稀盐酸:CO32-+2H+=CO2↑+H2O |
下列叙述中正确的是( )
| A、加热蒸干灼烧FeCl3溶液,最后所得固体为Fe(OH)3 |
| B、将pH=4的醋酸溶液稀释后,溶液中所有离子浓度都降低 |
| C、pH相同,体积相同的醋酸溶液和稀硫酸分别与足量锌充分反应,产生氢气的量相同 |
| D、若弱酸HA的酸性强于弱酸HB,则同浓度钠盐溶液的碱性:NaA<NaB |

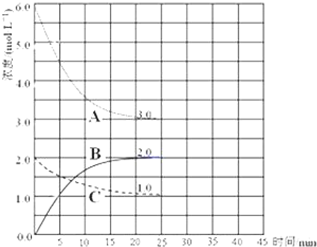 目前工业合成氨的原理是:N2(g)+3H2(g)?2NH3(g)△H=-93.0kJ/mol;
目前工业合成氨的原理是:N2(g)+3H2(g)?2NH3(g)△H=-93.0kJ/mol;

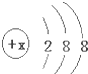 有几种元素的微粒的最外电子层结构如图所示,其中:
有几种元素的微粒的最外电子层结构如图所示,其中: