题目内容
8.下列关于离子共存或离子反应的说法正确的是( )| A. | 碱性溶液中可能大量存在Na+、I-、SO42-、ClO- | |
| B. | 弱碱性溶液中可能大量存在K+、Cl-、HCO3-、AlO2- | |
| C. | Fe(NO3)3溶液中加入足量HI溶液的反应:2Fe3++2I-=2Fe2++I2 | |
| D. | 向白色ZnS沉淀上滴加CuSO4溶液,白色沉淀变黑的离子方程式:ZnS(s)+Cu2+(aq)=CuS(s)+Zn2+(aq) |
分析 A.离子之间发生氧化还原反应;
B.AlO2-促进HCO3-的电离;
C.漏写硝酸与碘离子发生氧化还原反应;
D.发生沉淀的转化.
解答 解:A.I-、ClO-发生氧化还原反应,不能共存,故A错误;
B.AlO2-促进HCO3-的电离,不能共存,故B错误;
C.Fe(NO3)3溶液中加入足量HI溶液的反应的离子反应为12H++3NO3-+Fe3++10I-=Fe2++3NO↑+6H2O+5I2,故C错误;
D.发生沉淀的转化,离子反应为ZnS(s)+Cu2+(aq)=CuS(s)+Zn2+(aq),故D正确;
故选D.
点评 本题考查离子共存及离子反应,为高频考点,把握习题中的信息、氧化还原反应、沉淀转化为解答的关键,侧重分析与应用能力的考查,综合性较强,题目难度不大.

练习册系列答案
 计算高手系列答案
计算高手系列答案
相关题目
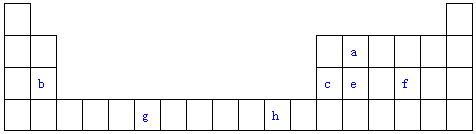
18.A、B、C、D、E是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如表:
请回答下列问题(用对应元素的元素符号作答):
(1)写出D元素基态原子的价电子排布式3s23p1,E2+价电子的轨道表示式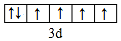 .
.
(2)这5种元素中电负性最大的元素是O(填元素符号),A、B、C三种元素的第一电离能由大到小的顺序为N>O>C(填元素符号)
(3)B、C、D的简单离子的半径由大到小的顺序为N3->O2->Al3+(用离子符号表示)
(4)写出C的核外有18个电子的氢化物的电子式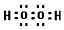 .
.
| 元素 | 相关信息 |
| A | 基态原子的价电子排布式为nSnnPn |
| B | 基态原子中的未成对电子数是同周期中最多的 |
| C | 最外层电子数是电子层数的3倍 |
| D | 简单离子是第三周期元素中离子半径最小的 |
| E | 价电子层中的未成对电子数为4 |
(1)写出D元素基态原子的价电子排布式3s23p1,E2+价电子的轨道表示式
 .
.(2)这5种元素中电负性最大的元素是O(填元素符号),A、B、C三种元素的第一电离能由大到小的顺序为N>O>C(填元素符号)
(3)B、C、D的简单离子的半径由大到小的顺序为N3->O2->Al3+(用离子符号表示)
(4)写出C的核外有18个电子的氢化物的电子式
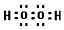 .
.
19.烯烃、炔烃因含不饱和键能被酸性KMnO4溶液氧化,下列各物质中不属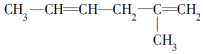 被酸性高锰酸钾氧化的产物的是( )
被酸性高锰酸钾氧化的产物的是( )
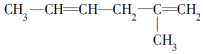 被酸性高锰酸钾氧化的产物的是( )
被酸性高锰酸钾氧化的产物的是( )| A. | CO2 | B. | CH3COOH | ||
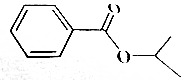
| C. | 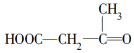 | D. | HOOC-CH2-CH2-COOH |
3.下列叙述错误的是( )
| A. | 乙烯和苯使溴水褪色的原因不同 | |
| B. | 苯和氢气在一定条件下生成环己烷的反应为还原反应 | |
| C. | 硝基苯和乙酸乙酯的制备都发生了取代反应 | |
| D. | 由乙醇制取乙烯发生了氧化反应 |
13. 某有机物结构如图所示,有关该物质的叙述正确的是( )
某有机物结构如图所示,有关该物质的叙述正确的是( )
 某有机物结构如图所示,有关该物质的叙述正确的是( )
某有机物结构如图所示,有关该物质的叙述正确的是( )| A. | 该物质易溶于水,不溶于乙醇、乙醚 | |
| B. | 该物质能发生加成、氧化.水解等反应 | |
| C. | 1mol该物质最多能与4mol氢气加成 | |
| D. | 该物质所有碳原子可能共平面 |
20.在给定条件下,下列选项所示的物质间转化均能实现的是( )
| A. | SiO2$\stackrel{HCl(aq)}{→}$SiCl4$\frac{{H}_{2}}{高温}$Si | |
| B. | MgCO3$\stackrel{HCl(aq)}{→}$MgCl2(aq)$\stackrel{电解}{→}$Mg | |
| C. | N2$→_{高温、高压、催化剂}^{H_{2}}$NH${\;}_{{\;}_{3}}$$\stackrel{HCl(aq)}{→}$NH4Cl(aq) | |
| D. | FeS$\stackrel{HCl(aq)}{→}$H2S$→_{煅烧}^{O_{2}}$SO2$→_{点燃}^{氧气}$H2SO4 |
17.煤的液化可以合成甲醇.下列有关说法正确的是
①“气化”:C(s)+2H2O(g)═CO2(g)+2H2(g);△H1=90.1kJ•mol-1
②催化液化I:CO2(g)+3H2(g)═CH3OH(g)+H2O(g);△H2=-49.0kJ•mol-1
③催化液化 II:CO2(g)+2H2(g)═CH3OH(g)+$\frac{1}{2}$O2(g);△H3=akJ•mol-1( )
①“气化”:C(s)+2H2O(g)═CO2(g)+2H2(g);△H1=90.1kJ•mol-1
②催化液化I:CO2(g)+3H2(g)═CH3OH(g)+H2O(g);△H2=-49.0kJ•mol-1
③催化液化 II:CO2(g)+2H2(g)═CH3OH(g)+$\frac{1}{2}$O2(g);△H3=akJ•mol-1( )

| A. | 催化液化I中使用催化剂,反应的活化能Ea、△H2都减小 | |
| B. | 反应C(s)+H2O(g)+H2(g)=CH3OH(g)△H=41.1 kJ•mol-1 | |
| C. | △H2>△H3 | |
| D. | 图为甲醇燃料电池的工作原理,负极的电极反应为:CH3OH-6e-+6OH-═CO2+5H2O |