题目内容
4.用铂作电极电解足量的某金属的氯化物(XCl2)溶液,当电路中有6.02×1022个电子通过时,阴极增重3.2g,求:(1)标准状况下产生气体的体积;
(2)该金属的相对原子质量.
分析 转移电子的物质的量=$\frac{6.02×1{0}^{22}}{6.02×1{0}^{23}/mol}$=0.1mol,
(1)阳极上氯离子放电生成氯气,根据氯气和转移电子之间关系式计算氯气体积;
(2)根据化学式知,X化合价为+2价,根据转移电子知,金属n=$\frac{0.1mol}{2}$=0.05mol,M=$\frac{m}{n}$得X摩尔质量,在数值上等于其相对原子质量.
解答 解:转移电子的物质的量=$\frac{6.02×1{0}^{22}}{6.02×1{0}^{23}/mol}$=0.1mol,
(1)阳极上氯离子放电生成氯气,根据氯气和转移电子之间关系式得氯气体积=$\frac{0.1mol}{2}×22.4L/mol$=1.12L,答:标况下产生气体体积为1.12L;
(2)根据化学式知,X化合价为+2价,根据转移电子知,金属n=$\frac{0.1mol}{2}$=0.05mol,M=$\frac{m}{n}$=$\frac{3.2g}{0.05mol}$=64g/mol,在数值上等于其相对原子质量为64,答:该金属的相对原子质量为64.
点评 本题以电解原理为载体考查物质的量有关计算,为高频考点,明确各个物理量关系是解本题关键,熟悉各个物理量之间的换算,题目难度不大.

练习册系列答案
 黄冈创优卷系列答案
黄冈创优卷系列答案
相关题目
6.下列化学反应的离子方程式正确的是( )
| A. | 向Na2SiO3溶液中通入过量CO2:SiO32-+2CO2+2H2O═2HCO3-+H2SiO3↓ | |
| B. | 少量SO2通入漂白粉溶液中:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO | |
| C. | 用稀HNO3溶解FeS固体:FeS+2H+═Fe2++H2S↑ | |
| D. | 向NH4HCO3溶液中加入足量Ba(OH)2溶液:2HCO3-+Ba2++2OH-═BaCO3↓+CO32-+2H2O |
15.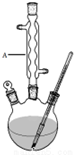 冬青油又叫水杨酸甲酯,是一种重要的有机合成原料.某化学小组用水杨酸(
冬青油又叫水杨酸甲酯,是一种重要的有机合成原料.某化学小组用水杨酸(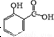 )和甲醇在酸性催化剂催化下合成水杨酸甲酯并计算其产率.
)和甲醇在酸性催化剂催化下合成水杨酸甲酯并计算其产率.
实验步骤:
Ⅰ.如图,在三颈烧瓶中加入13.8g (0.1mol)水杨酸和24g(30mL,0.75mol)甲醇,向混合物中加入约10mL甲苯(甲苯与水形成的共沸物,沸点为85℃,该实验中加入甲苯,易将水蒸出),再小心地加入5mL浓硫酸,摇动混匀,加入1~2粒沸石,组装好实验装置,在85~95℃下恒温加热反应1.5小时:
Ⅱ.待装置冷却后,分离出甲醇,然后转移至分液漏斗,依次用少量水、5%NaHCO3溶液和水洗涤;分出的产物加入少量无水MgSO4固体,过滤得到粗酯;
Ⅲ.将粗酯进行蒸馏,收集221℃~224℃的馏分,得水杨酸甲酯9.12g.
常用物理常数:
请根据以上信息回答下列问题:
(1)仪器A的名称是球形冷凝管,加入沸石的作用是防止暴沸.若加热后发现未加沸石,应采取的正确方法是停止加热,待冷却后加入.
(2)制备水杨酸甲酯时,最合适的加热方法是水浴加热.
(3)实验中加入甲苯对合成水杨酸甲酯的作用是加入甲苯易将水蒸出,使平衡向右移动,从而提高反应的产率.
(4)反应结束后,分离出甲醇采用的方法是蒸馏(或水洗分液).
(5)实验中加入无水硫酸镁的作用是除水或干燥.本实验的产率为60%(保留两位有效数字).
 冬青油又叫水杨酸甲酯,是一种重要的有机合成原料.某化学小组用水杨酸(
冬青油又叫水杨酸甲酯,是一种重要的有机合成原料.某化学小组用水杨酸( )和甲醇在酸性催化剂催化下合成水杨酸甲酯并计算其产率.
)和甲醇在酸性催化剂催化下合成水杨酸甲酯并计算其产率.实验步骤:
Ⅰ.如图,在三颈烧瓶中加入13.8g (0.1mol)水杨酸和24g(30mL,0.75mol)甲醇,向混合物中加入约10mL甲苯(甲苯与水形成的共沸物,沸点为85℃,该实验中加入甲苯,易将水蒸出),再小心地加入5mL浓硫酸,摇动混匀,加入1~2粒沸石,组装好实验装置,在85~95℃下恒温加热反应1.5小时:
Ⅱ.待装置冷却后,分离出甲醇,然后转移至分液漏斗,依次用少量水、5%NaHCO3溶液和水洗涤;分出的产物加入少量无水MgSO4固体,过滤得到粗酯;
Ⅲ.将粗酯进行蒸馏,收集221℃~224℃的馏分,得水杨酸甲酯9.12g.
常用物理常数:
| 名称 | 分子量 | 颜色状态 | 相对密度 | 熔点(℃) | 沸点(℃) |
| 水杨酸甲酯 | 152 | 无色液体 | 1.18 | -8.6 | 224 |
| 水杨酸 | 138 | 白色晶体 | 1.44 | 158 | 210 |
| 甲醇 | 32 | 无色液体 | 0.792 | -97 | 64.7 |
(1)仪器A的名称是球形冷凝管,加入沸石的作用是防止暴沸.若加热后发现未加沸石,应采取的正确方法是停止加热,待冷却后加入.
(2)制备水杨酸甲酯时,最合适的加热方法是水浴加热.
(3)实验中加入甲苯对合成水杨酸甲酯的作用是加入甲苯易将水蒸出,使平衡向右移动,从而提高反应的产率.
(4)反应结束后,分离出甲醇采用的方法是蒸馏(或水洗分液).
(5)实验中加入无水硫酸镁的作用是除水或干燥.本实验的产率为60%(保留两位有效数字).
12. 化学兴趣小组的同学用0.100 0 mol/L 盐酸标准溶液测定某烧碱样品的纯度(杂质不与盐酸反应).实验步骤如下:
化学兴趣小组的同学用0.100 0 mol/L 盐酸标准溶液测定某烧碱样品的纯度(杂质不与盐酸反应).实验步骤如下:
(1)配制待测液:用分析天平准确称取烧碱样品2.500 g,全部溶于水配制成500 mL溶液.配制溶液需用的玻璃仪器除了烧杯、胶头滴管外,还需要500mL容量瓶、量筒.
(2)滴定:
①用碱式滴定管量取20.00mL所配溶液放在锥形瓶中,滴加几滴指示剂,待测.滴定管在装入反应液之前应进行的操作有检查滴定管是否漏水,洗净并用待盛装的溶液润洗滴定管2~3次.
②用浓度为0.100 0mol/L的盐酸标准溶液进行滴定.开始滴定前的一步操作是调节液面于“0”刻度或“0”刻度以下.
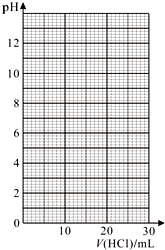
③滴定过程中用pH计测定锥形瓶中溶液的pH,临近滴定终点时每滴一滴测一次pH.滴定过程中,测得锥形瓶中溶液的pH变化如下表:
(3)数据处理:
①在坐标图中绘出上述中和滴定曲线.
②所测样品中NaOH的质量百分含量为96%.
 化学兴趣小组的同学用0.100 0 mol/L 盐酸标准溶液测定某烧碱样品的纯度(杂质不与盐酸反应).实验步骤如下:
化学兴趣小组的同学用0.100 0 mol/L 盐酸标准溶液测定某烧碱样品的纯度(杂质不与盐酸反应).实验步骤如下:(1)配制待测液:用分析天平准确称取烧碱样品2.500 g,全部溶于水配制成500 mL溶液.配制溶液需用的玻璃仪器除了烧杯、胶头滴管外,还需要500mL容量瓶、量筒.
(2)滴定:
①用碱式滴定管量取20.00mL所配溶液放在锥形瓶中,滴加几滴指示剂,待测.滴定管在装入反应液之前应进行的操作有检查滴定管是否漏水,洗净并用待盛装的溶液润洗滴定管2~3次.
②用浓度为0.100 0mol/L的盐酸标准溶液进行滴定.开始滴定前的一步操作是调节液面于“0”刻度或“0”刻度以下.
③滴定过程中用pH计测定锥形瓶中溶液的pH,临近滴定终点时每滴一滴测一次pH.滴定过程中,测得锥形瓶中溶液的pH变化如下表:
| V(HCl)/mL | 0.00 | 12.00 | 18.00 | 22.00 | 23.00 | 23.96 |
| pH | 13.1 | 12.6 | 12.2 | 11.7 | 11.4 | 9.9 |
| V(HCl)/mL | 24.00 | 24.04 | 25.00 | 26.00 | 30.00 | |
| pH | 7.0 | 4.0 | 2.7 | 2.4 | 1.9 |
①在坐标图中绘出上述中和滴定曲线.
②所测样品中NaOH的质量百分含量为96%.
9.下列两种溶液混合后,所得溶液中各离子浓度关系不正确的是( )
| A. | 0.1 mol/L的NaOH溶液与0.1 mol/L的CH3COOH溶液等体积混合c(Na+)>c(OH-)>c(CH3COO-)>c(H+) | |
| B. | 常温下,0.01 mol/L的NaOH溶液与pH=2的CH3COOH溶液等体积混合c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| C. | 常温下,0.1 mol/L的CH3COOH溶液与0.1 mol/L的NaOH溶液混合后使pH=7,c(CH3COO-)=c(Na+)>c(H+)=c(OH-) | |
| D. | 0.1 mol/L的CH3COOH溶液和0.1 mol/L的CH3COONa溶液等体积混合c(CH3COO-)+c(OH-)=c(Na+)+c(H+) |
16.能表示人体大量喝水时,胃液的pH变化的是( )
| A. |  | B. |  | C. |  | D. |  |
14.在溶液导电性实验中,往氢氧化钡溶液中滴加硫酸至过量,灯泡的明亮度变化是:明→暗→明,下列说法正确的是( )
| A. | 溶液的导电性与溶液中离子的浓度有关 | |
| B. | 溶液的导电性与溶液中离子数目的多少有关 | |
| C. | 灯泡最暗时溶液中无自由移动的离子 | |
| D. | 往氢氧化钡溶液中滴加盐酸与滴加硫酸时现象相同 |