题目内容
1.已知1~18号元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是( )| A. | 质子数c>d,离子的还原性Y2->Z- | B. | 氢化物的稳定性H2Y>HZ | ||
| C. | 原子半径X<W,第一电离能X<W | D. | 电负性Z>Y>W>X |
分析 元素周期表前三周期元素的离子aW3+、bX+、cY2-、dZ-具有相同电子层结构,核外电子数相等,所以a-3=b-1=c+2=d+1,Y、Z为非金属,应处于第二周期,故Y为O元素,Z为F元素,W、X为金属应处于第三周期,W为Al元素,X为Na元素,结合元素周期律解答.
解答 解:元素周期表前三周期元素的离子aW3+、bX+、cY2-、dZ-具有相同电子层结构,核外电子数相等,所以a-3=b-1=c+2=d+1,Y、Z为非金属,应处于第二周期,故Y为O元素,Z为F元素,W、X为金属应处于第三周期,W为Al元素,X为Na元素,
A.由以上分析可知c=8,b=11,则质子数c<b,非金属性F>O,非金属性越强,对应的单质的氧化性越强,则阴离子的还原性越弱,则离子还原性O2->F-,故A错误;
B.非金属性F>O,非金属性越强氢化物越稳定性,氢化物稳定性为HF>H2O,故B错误;
C.W为Al元素,X为Na元素,同周期随原子序数增大原子半径减小、第一电离能呈增大趋势,故原子半径Na>Al,第一电离能Al<Na,故C错误;
D.同周期自左而右电负性增大,同主族自上而下电负性减小,故电负性:Z(F)>Y(O)>W(Al)>X(Na),故D正确.
故选D.
点评 本题考查原子结构与元素周期律的相关知识,可以根据电子层结构确定在周期表中的位置关系,从而推断其性质,不需要确定具体的元素,注意同周期第一电离能异常情况.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目
12.下列反应过程中的能量变化情况符合图的是( )


| A. | 酸与碱的中和反应 | B. | 石灰石高温分解反应 | ||
| C. | 镁和盐酸的反应 | D. | 氧化钙和水的反应 |
9.在一定条件下,使NO和O2在一密闭容器中进行反应2NO+O2?2NO2,下列说法中不正确的是( )
| A. | 反应开始时,正反应速率最大,逆反应速率为零 | |
| B. | 随着反应的进行,正反应速率逐渐减小,最后为零 | |
| C. | 随着反应的进行,正反应速率逐渐减小,逆反应速率逐渐增大 | |
| D. | 随着反应的进行,逆反应速率逐渐增大,最后与正反应速率相等 |
16.下列各说法正确的是( )
| A. | 对于2SO2(g)+O2(g)?2SO3(g)△H=-QkJ/mol(Q>0),若向一密闭容器中加入1molSO2和0.5molO2充分反应后,放出的热量为0.5QkJ | |
| B. | 热化学方程式中的化学计量数表示相应物质的物质的量,不能用分数表示 | |
| C. | 需要加热才能发生的反应不一定是吸热反应 | |
| D. | 小苏打在水中的电离方程式:NaHCO3═Na++H++CO${\;}_{3}^{2-}$ |
13.化学与生活息息相关,下列说法错误的是( )
| A. | 硅胶多孔,常用作食品干燥剂和催化剂的载体 | |
| B. | 用灼烧和闻气味的方法区别棉织物和纯毛织物 | |
| C. | 用SO2漂白过的草帽缏日久会变色 | |
| D. | 氯气处理饮用水,在夏季的杀菌效果比在冬季好 |
10.下列各组微粒,半径大小比较中错误的是( )
| A. | K>K+ | B. | Na+>Mg2+>Al3+ | C. | Na+>F- | D. | Cl->Na+ |
11.W是由短周期元素X、Y、Z组成的盐.X、Y、Z原子的最外层电子数依次增大,Z原子最外层电子数是内层电子数的3倍;X、Y原子最外层电子数之和等于Z原子的最外层电子数;Y、Z同周期且相邻,但与X不同周期.下列说法一定正确的是( )
| A. | 三种元素的最高正化合价中,Z的最大 | |
| B. | W溶液显碱性或中性 | |
| C. | 原子半径:X>Y>Z | |
| D. | Y的最高价氧化物对应的水化物是强酸. |


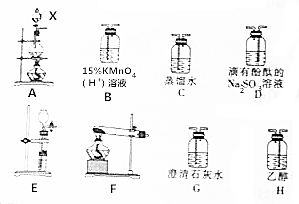 CH3Cl为无色、略带臭味的气体,密度为2.25g•L-1,沸点为-23.7℃,难容于水,易溶于乙醇和丙醇等有机溶剂.实验室将甲醇与浓盐酸共热(ZnCl2作催化剂)制备CH3Cl,某化学实验小组利用下列装置制备并探究CH3Cl的性质.
CH3Cl为无色、略带臭味的气体,密度为2.25g•L-1,沸点为-23.7℃,难容于水,易溶于乙醇和丙醇等有机溶剂.实验室将甲醇与浓盐酸共热(ZnCl2作催化剂)制备CH3Cl,某化学实验小组利用下列装置制备并探究CH3Cl的性质.