题目内容
20.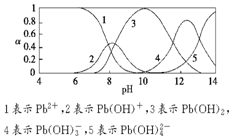 水体中重金属铅的污染问题备受关注.水溶液中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2(微溶)、Pb(OH)3-、Pb(OH)42-,各形态的浓度分数α随溶液pH变化的关系如图所示.
水体中重金属铅的污染问题备受关注.水溶液中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2(微溶)、Pb(OH)3-、Pb(OH)42-,各形态的浓度分数α随溶液pH变化的关系如图所示.(1)Pb(NO3)2溶液中,$\frac{c(N{{O}_{3}}^{-})}{c(P{b}^{2+})}$>2(填“>”“=”或“<”),往该溶液中滴入氯化铵溶液后,$\frac{c(N{{O}_{3}}^{-})}{c(P{b}^{2+})}$增加,可能的原因是Pb2+与Cl-反应生成难溶于冷水的氯化铅,使Pb2+浓度减少.
(2)往Pb(NO3)2溶液中滴入稀NaOH溶液,pH=8时溶液中存在的阳离子(Na+除外)有Pb2+、Pb(OH)+、H+,pH=9时主要反应的离子方程式为Pb2++2OH-═Pb(OH)2↓.
分析 (1)因为Pb(NO3)2是一种强酸弱碱盐,Pb2+发生水解,使c(Pb2+)减小;滴入氯化铵溶液生成PbCl2沉淀,使Pb2+浓度降低;
(2)pH=9时,曲线2、3表示的物质共存,由图可知Pb(OH)2的浓度分数比Pb(OH)+的大,所以主要反应是生成Pb(OH)2,pH=12时,Pb(OH)3-、Pb(OH)42-共存.
解答 解:(1)因为Pb(NO3)2是一种强酸弱碱盐,在水溶液中存在如下水解平衡:2H2O+Pb2+?Pb(OH)2+2H+,使c(Pb2+)减小,所以 $\frac{c(N{{O}_{3}}^{-})}{c(P{b}^{2+})}$>2,往该溶液中滴入氯化铵溶液后,发生Pb2++SO42-═PbSO4↓,使Pb2+浓度降低,则$\frac{c(N{{O}_{3}}^{-})}{c(P{b}^{2+})}$增加;
故答案为:>;Pb2+与Cl-反应生成难溶于冷水的氯化铅,使Pb2+浓度减少;
(2)由图象可知pH=8时,Pb2+,Pb(OH)+和Pb(OH)2共存,另外溶液中还有H+,所以中存在的阳离子(Na+除外)有Pb2+、Pb(OH)+、H+;pH=9时,曲线2、3表示的物质共存,由图可知Pb(OH)2的浓度分数比Pb(OH)+的大,所以主要反应是生成Pb(OH)2,反应的方程式为Pb2++2OH-═Pb(OH)2↓;
故答案为:Pb2+、Pb(OH)+、H+;Pb2++2OH-═Pb(OH)2↓.
点评 本题以Pb2+在水溶液中的各种形态与溶液中pH变化关系图,考查了学生在对多重平衡的函数曲线理解,是一个典型的利用多元信息,综合性考查学生知识与能力的创新型题目,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.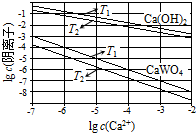 已知氢氧化钙和钨酸钙(CaWO4)都是微溶电解质,两者的溶解度均随温度升高而减小.在钨冶炼工艺中,将氢氧化钙加入钨酸钠碱性溶液中得到钨酸钙,发生反应
已知氢氧化钙和钨酸钙(CaWO4)都是微溶电解质,两者的溶解度均随温度升高而减小.在钨冶炼工艺中,将氢氧化钙加入钨酸钠碱性溶液中得到钨酸钙,发生反应
Ⅰ:WO42-(aq)+Ca(OH)2(s)?CaWO4(s)+2OH-(aq).
(1)如图为不同温度下Ca(OH)2、CaWO4的沉淀溶解平衡曲线.
①计算T1时KSP(CaWO4)=1×10-10.
②T1< T2(填“>”“=”或“<”).
(2)反应Ⅰ的平衡常数K理论值如表:
①该反应平衡常数K的表达式为$\frac{{c}^{2}(O{H}^{-})}{c(W{{O}_{4}}^{2-})}$.
②该反应的△H>0(填“>”“=”或“<”).
(3)常温下向较浓AlCl3的溶液中不断通入HCl气体,可析出大量AlCl3•6H2O晶体,结合化学平衡移动原理解释析出晶体的原因:AlCl3饱和溶液中存在溶解平衡:AlCl3•6H2O(s)═Al3+(aq)+3Cl-(aq)+6H2O(l),通入HCl气体使溶液中c(Cl-)增大,平衡向析出固体的方向移动从而析出AlCl3•6H2O晶体.
 已知氢氧化钙和钨酸钙(CaWO4)都是微溶电解质,两者的溶解度均随温度升高而减小.在钨冶炼工艺中,将氢氧化钙加入钨酸钠碱性溶液中得到钨酸钙,发生反应
已知氢氧化钙和钨酸钙(CaWO4)都是微溶电解质,两者的溶解度均随温度升高而减小.在钨冶炼工艺中,将氢氧化钙加入钨酸钠碱性溶液中得到钨酸钙,发生反应Ⅰ:WO42-(aq)+Ca(OH)2(s)?CaWO4(s)+2OH-(aq).
(1)如图为不同温度下Ca(OH)2、CaWO4的沉淀溶解平衡曲线.
①计算T1时KSP(CaWO4)=1×10-10.
②T1< T2(填“>”“=”或“<”).
(2)反应Ⅰ的平衡常数K理论值如表:
| 温度/℃ | 25 | 50 | 90 | 100 |
| K | 79.96 | 208.06 | 222.88 | 258.05 |
②该反应的△H>0(填“>”“=”或“<”).
(3)常温下向较浓AlCl3的溶液中不断通入HCl气体,可析出大量AlCl3•6H2O晶体,结合化学平衡移动原理解释析出晶体的原因:AlCl3饱和溶液中存在溶解平衡:AlCl3•6H2O(s)═Al3+(aq)+3Cl-(aq)+6H2O(l),通入HCl气体使溶液中c(Cl-)增大,平衡向析出固体的方向移动从而析出AlCl3•6H2O晶体.
8.阿伏加德罗常数约为6.02×1023mol-1,下列说法中错误的是( )
| A. | 标准状况下,3.01×1023个CCl4所占的体积约为11.2 L | |
| B. | 80 g NH4NO3晶体中约含有NH4+ 6.02×1023个 | |
| C. | 3.9 gNa2O2吸收足量的CO2时转移的电子数约是3.01×1022 | |
| D. | 46 g NO2和N2O4混合气体中含有原子数约为1.806×1024 |
9.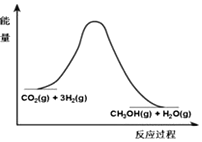 由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引用了各界的普遍重视.目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),该反应的能量变化如图所示:
由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引用了各界的普遍重视.目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),该反应的能量变化如图所示:
(1)上述反应平衡常数K的表达式为$\frac{c({H}_{2}O)c(C{H}_{3}OH)}{{c}^{3}({H}_{2})c(C{O}_{2})}$,温度降低,平衡常数K增大(填“增大”、“不变”或“减小”).
(2)在体积为2L的密闭容器中,充入1mol CO2和3mol H2,测得CO2的物质的量随时间变化如表所示.从反应开始到5min末,用CO2浓度变化表示的平均反应速率v(CO2)=0.05mol/(L•min).
(3)下列条件能使上述反应的反应速率增大,且平衡向正反应方向移动的是C(填写序号字母)
A.及时分离出CH3OH气体 B.适当升高温度
C.保持容器的容积不变,再充入1mol CO2和3mol H2D.选择高效催化剂.
 由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引用了各界的普遍重视.目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),该反应的能量变化如图所示:
由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引用了各界的普遍重视.目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),该反应的能量变化如图所示:(1)上述反应平衡常数K的表达式为$\frac{c({H}_{2}O)c(C{H}_{3}OH)}{{c}^{3}({H}_{2})c(C{O}_{2})}$,温度降低,平衡常数K增大(填“增大”、“不变”或“减小”).
(2)在体积为2L的密闭容器中,充入1mol CO2和3mol H2,测得CO2的物质的量随时间变化如表所示.从反应开始到5min末,用CO2浓度变化表示的平均反应速率v(CO2)=0.05mol/(L•min).
| t/min | 0 | 2 | 5 | 10 | 15 |
| n(CO2)/mol | 1 | 0.75 | 0.5 | 0.25 | 0.25 |
A.及时分离出CH3OH气体 B.适当升高温度
C.保持容器的容积不变,再充入1mol CO2和3mol H2D.选择高效催化剂.