题目内容
9.硫酰氯(SO2Cl2)常作氯化剂或氯磺化剂,用于制作药品、染料、表面活性剂等.有关物质的部分性质如表:
| 物质 | 熔点/℃ | 沸点/℃ | 其它性质 |
| SO2Cl2 | -54.1 | 69.1 | ①易与水反应,产生大量白雾 ②易分解:SO2Cl2$\frac{\underline{\;100℃\;}}{\;}$SO2↑+Cl2↑ |
| H2SO4 | 10.4 | 338 | 吸水性且不易分解 |
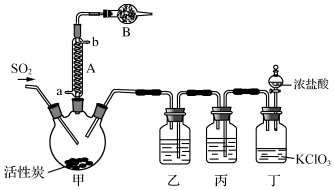
(1)仪器A冷却水的进口为a(填“a”或“b”).
(2)仪器B中盛放的药品是碱石灰.
(3)实验所需二氧化硫用亚硫酸钠与硫酸制备,该反应的离子方程式为SO32-+2H+=SO2↑+H2O,以下与二氧化硫有关的说法中正确的是BE.
A.因为SO2具有漂白性,所以它能使品红溶液、溴水、酸性KMnO4溶液、石蕊试液褪色
B.能使品红溶液褪色的物质不一定是SO2
C.SO2、漂白粉、活性炭、Na2O2都能使红墨水褪色,且原理相同
D.等物质的量的SO2和Cl2混合后通入装有湿润的有色布条的集气瓶中,漂白效果更好
E.可用浓硫酸干燥SO2
F.可用澄清的石灰水鉴别SO2和CO2
(4)装置丙所盛试剂为除去Cl2中的HCl,若缺少装置乙,则硫酰氯会损失,该反应的化学方程式为SO2Cl2+2H2O═H2SO4+2HCl.
(5)少量硫酰氯也可用氯磺酸(ClSO3H)分解获得,该反应的化学方程式为:2ClSO3H═H2SO4+SO2Cl2,此方法得到的产品中会混有硫酸.
①从分解产物中分离出硫酰氯的方法是蒸馏.
②请设计实验方案检验产品中有硫酸(可选试剂:稀盐酸、稀硝酸、BaCl2溶液、蒸馏水、石蕊溶液):取产物在干燥条件下加热至完全反应(或挥发或分解等),冷却后加水稀释;取少量溶液滴加紫色石蕊试液变红;再取少量溶液,加入BaCl2溶液产生白色沉淀,说明含有H2SO4.或取反应后的产物直接加BCl2溶液,有白色沉淀,再滴加紫色石蕊试液变红,说明含有H2SO4.
分析 二氧化硫和氯气合成硫酰氯:甲装置:SO2(g)+Cl2(g)$\frac{\underline{\;活性炭\;}}{\;}$SO2Cl2;硫酰氯会水解,仪器B中盛放的药品是碱石灰防止空气中的水蒸气进入装置,同时吸收挥发出去的二氧化硫和氯气,丁装置:浓盐酸和氯酸钾反应制取氯气,浓盐酸易挥发,制取的氯气中含有氯化氢,丙装置:除去Cl2中的HCl,乙装置:干燥氯气.
(1)根据采用逆流的冷凝效果好,判断冷凝管的进水口;
(2)仪器B中盛放的药品是碱石灰防止空气中的水蒸气进入装置,同时吸收挥发出去的二氧化硫和氯气;
(3)实验时,装置丁中氯酸钾+5价的氯和盐酸中-1价的氯发生氧化还原反应生成氯气;
(4)盐酸易挥发,制取的氯气中含有氯化氢,丙装置:除去Cl2中的HCl;SO2Cl2遇水生成硫酸和氯化氢,根据原子守恒书写;二氧化硫具有漂白性、氧化剂、还原性;
(5)①二者沸点相差较大,采取蒸馏法进行分离;
②氯磺酸(ClSO3H)分解:2ClSO3H═H2SO4+SO2Cl2,设计实验方案检验产品,需检验氢离子、检验硫酸根离子.
解答 解:(1)根据采用逆流的冷凝效果好,所以冷凝管中的冷却水进口为a,
故答案为:a;
(2)甲装置:SO2(g)+Cl2(g)$\frac{\underline{\;活性炭\;}}{\;}$SO2Cl2,二氧化硫、氯气为有毒的酸性气体,产物硫酰氯会水解,所以仪器B中盛放的药品是碱性物质碱石灰,可防止空气中的水蒸气进入装置,同时吸收挥发出去的二氧化硫和氯气,
故答案为:碱石灰;
(3)用亚硫酸钠与硫酸制备二氧化硫,该反应的离子方程式为:SO32-+2H+=SO2↑+H2O,
A.因为SO2具有漂白性,它能使品红溶液褪色,与溴水、酸性KMnO4溶液发生氧化还原反应,使石蕊试液变红,故A错误;
B.能使品红溶液褪色的物质可能是SO2,或氯气等,故B正确;
C.SO2、漂白粉、活性炭、Na2O2都能使红墨水褪色,原理分别为化合反应、强氧化性、吸附性、强氧化性,故C错误;
D.等物质的量的SO2和Cl2混合后生成盐酸和硫酸,不具有通漂白效果,故D错误;
E.二者不反应,可用浓硫酸干燥SO2,故E正确;
F.二者均与石灰水反应生成白色沉淀,则不能用澄清的石灰水鉴别SO2和CO2,故F错误;
故答案为:ClO3-+5Cl-+6H+=3Cl2↑+3H2O;BE;
(4)盐酸易挥发,制取的氯气中含有氯化氢,氯气难溶于饱和食盐水;HCl易溶于水,而氯气难溶于饱和食盐水,可用饱和NaCl溶液除去Cl2中的少量HCl,所以丙装置作用为诶:除去Cl2中的HCl,SO2Cl2遇水生成硫酸和氯化氢,则其水解方程式为:SO2Cl2+2H2O═H2SO4+2HCl,
故答案为:除去Cl2中的HCl;SO2Cl2+2H2O═H2SO4+2HCl;
(5)①二者为互溶液体,沸点相差较大,采取蒸馏法进行分离,故答案为:蒸馏;
②氯磺酸(ClSO3H)分解:2ClSO3H=H2SO4+SO2Cl2,取产物在干燥条件下加热至完全反应(或挥发或分解等),冷却后加水稀释;取少量溶液滴加紫色石蕊试液变红,证明溶液呈酸性,再取少量溶液,加入BaCl2溶液产生白色沉淀,说明含有H2SO4,或取反应后的产物直接加BCl2溶液,有白色沉淀,证明含有硫酸根离子,再滴加紫色石蕊试液变红,说明含有H2SO4,
故答案为:取产物在干燥条件下加热至完全反应(或挥发或分解等),冷却后加水稀释;取少量溶液滴加紫色石蕊试液变红;再取少量溶液,加入BaCl2溶液产生白色沉淀,说明含有H2SO4.或取反应后的产物直接加BCl2溶液,有白色沉淀,再滴加紫色石蕊试液变红,说明含有H2SO4.
点评 本题考查物质的制备实验,为高频考点,把握实验原理、装置的作用、混合物分离提纯、实验技能等为解答的关键,侧重分析与实验能力的考查,注意元素化合物知识的应用,题目难度不大.

 名校课堂系列答案
名校课堂系列答案| A. | CH3-C≡CH和CH2=CH-CH=CH2 | B. | CH3-CH=CH2和 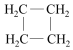 | ||
| C. | 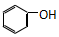 和 和 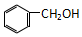 | D. | 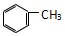 和 和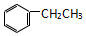 |
| 选项 | 被提纯的物质 | 杂质 | 除杂试剂 | 除杂方法 |
| A | Fe | Al | NaOH溶液 | 过滤 |
| B | 乙酸乙酯 | 乙醇 | 水 | 水洗、分液 |
| C | CO2 | SO2 | 饱和NaHCO3溶液、浓H2SO4 | 洗气 |
| D | NH4Cl(aq) | Cu2+(aq) | NaOH溶液 | 过滤 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 蒸馏操作时,冷凝管中冷却水应低进高出 | |
| B. | 萃取操作时,必须选择密度比水大的萃取剂 | |
| C. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 蒸发操作时,不能等到蒸发皿中水分完全蒸干后才停止加热 |
| A. | 标准状况下,22.4 L HF含有的分子数为 NA | |
| B. | 28 g N2和N4组成的混合气体中含有的原子数为2 NA | |
| C. | 1 mol•L-1A1Cl3溶液中含有的Cl-数目为3 NA | |
| D. | 5.6 gFe在0.1moCl2中充分燃烧,转移的电子数目为0.3NA |
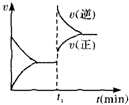
| A. | 4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H<0 | B. | 2SO2(g)+O2(g)?2SO3(g)△H<0 | ||
| C. | H2(g)+I2(g)?2HI(g)△H>0 | D. | C(s)+H2O(g)?CO(g)+H2(g)△H>0 |
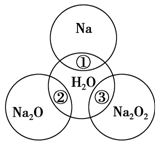 如图所示,两圆圈相交的部分表示圆圈内的物质相互发生的反应.已知钠及其氧化物的物质的量均为0.1mol,水的质量为100g,忽略溶液中溶剂的变化.完成下列题目.
如图所示,两圆圈相交的部分表示圆圈内的物质相互发生的反应.已知钠及其氧化物的物质的量均为0.1mol,水的质量为100g,忽略溶液中溶剂的变化.完成下列题目. .
.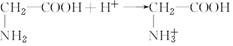 .
.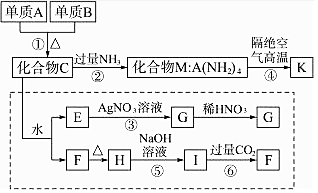 材料科学是近年来与化学有关的科学研究的重点,某新型无机非金属材料K由两种非金属元素组成,它是一种超硬物质,具有耐磨、耐腐蚀、抗冷热冲击、抗氧化等特性,它是以中学化学中的常见物质为原料来生产的.如图所示为其生产过程,其中虚线框内转化是为探究C的组成而设.已知A、B均为非金属单质,G、F、H均难溶于水且为白色粉末;图中除M、K(均含A元素)外均为中学化学常见物质:
材料科学是近年来与化学有关的科学研究的重点,某新型无机非金属材料K由两种非金属元素组成,它是一种超硬物质,具有耐磨、耐腐蚀、抗冷热冲击、抗氧化等特性,它是以中学化学中的常见物质为原料来生产的.如图所示为其生产过程,其中虚线框内转化是为探究C的组成而设.已知A、B均为非金属单质,G、F、H均难溶于水且为白色粉末;图中除M、K(均含A元素)外均为中学化学常见物质: