题目内容
4.下列实验操作中错误的是( )| A. | 蒸馏操作时,冷凝管中冷却水应低进高出 | |
| B. | 萃取操作时,必须选择密度比水大的萃取剂 | |
| C. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 蒸发操作时,不能等到蒸发皿中水分完全蒸干后才停止加热 |
分析 A.蒸馏时,冷水下进上出,在冷凝管中停留时间长,冷却效果好;
B.萃取时,不发生反应液,溶剂分层,且溶质在不同溶剂中的溶解性差异较大;
C.分液时,避免上下层液体混合;
D.蒸发时,不能蒸干,利用余热加热.
解答 解:A.蒸馏时,冷水下进上出,在冷凝管中停留时间长,冷却效果好,即冷凝管中冷却水应低进高出,故A正确;
B.萃取时,不发生反应液,溶剂分层,且溶质在不同溶剂中的溶解性差异较大,与密度无关,故B错误;
C.分液时,避免上下层液体混合,则分液漏斗中下层液体从下口放出,上层液体从上口倒出,故C正确;
D.蒸发时,不能蒸干,利用余热加热,则不能等到蒸发皿中水分完全蒸干后才停止加热,出现大量固体时停止加热,故D正确;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,把握混合物分离提纯、实验操作、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
14.设NA为阿伏伽德罗常数的值,下列有关其说法正确的是( )
| A. | 标准状况下,22.4LH2O含有的分子数为NA | |
| B. | 在常温和常压下,22gCO2含有的分子数为0.5NA | |
| C. | 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为NA | |
| D. | 在同温、同压下,相同体积的任何气体,所含分子数相同 |
15.已知:NA表示阿伏加德罗常数,则下列说法不正确的是( )
| A. | 31g白磷分子中所含p-p共价键数目为1.5NA | |
| B. | 标准状况下,2.24LD2中所含中子的数目是0.2NA | |
| C. | 常温常压下42g乙烯和丙烯的混合气体含氢原子数目为6 NA | |
| D. | 常温下,向1L0.2mol/L的盐酸溶液通入氨气,当溶液PH=7时,溶液中NH4+的数目小于0.2NA |
12.将足量的CO2气体通入下列溶液中,能产生沉淀的是( )
| A. | 氯化钙溶液 | B. | 石灰水 | C. | 次氯酸钠溶液 | D. | 硅酸钠溶液 |
19.下列实验装置设计正确、且能达到目的是( )
| A. |  用于除去CO2中的HCl | B. |  排水法收集NO | ||
| C. |  配制一定物质的量浓度的稀硫酸 | D. |  海水的淡化 |
9.硫酰氯(SO2Cl2)常作氯化剂或氯磺化剂,用于制作药品、染料、表面活性剂等.
有关物质的部分性质如表:
实验室用干燥而纯净的二氧化硫和氯气合成硫酰氯,装置如图所示(夹持仪器已省略),请回答有关问题:
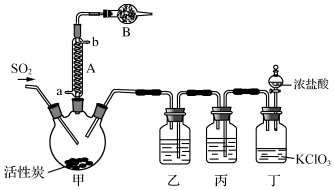
(1)仪器A冷却水的进口为a(填“a”或“b”).
(2)仪器B中盛放的药品是碱石灰.
(3)实验所需二氧化硫用亚硫酸钠与硫酸制备,该反应的离子方程式为SO32-+2H+=SO2↑+H2O,以下与二氧化硫有关的说法中正确的是BE.
A.因为SO2具有漂白性,所以它能使品红溶液、溴水、酸性KMnO4溶液、石蕊试液褪色
B.能使品红溶液褪色的物质不一定是SO2
C.SO2、漂白粉、活性炭、Na2O2都能使红墨水褪色,且原理相同
D.等物质的量的SO2和Cl2混合后通入装有湿润的有色布条的集气瓶中,漂白效果更好
E.可用浓硫酸干燥SO2
F.可用澄清的石灰水鉴别SO2和CO2
(4)装置丙所盛试剂为除去Cl2中的HCl,若缺少装置乙,则硫酰氯会损失,该反应的化学方程式为SO2Cl2+2H2O═H2SO4+2HCl.
(5)少量硫酰氯也可用氯磺酸(ClSO3H)分解获得,该反应的化学方程式为:2ClSO3H═H2SO4+SO2Cl2,此方法得到的产品中会混有硫酸.
①从分解产物中分离出硫酰氯的方法是蒸馏.
②请设计实验方案检验产品中有硫酸(可选试剂:稀盐酸、稀硝酸、BaCl2溶液、蒸馏水、石蕊溶液):取产物在干燥条件下加热至完全反应(或挥发或分解等),冷却后加水稀释;取少量溶液滴加紫色石蕊试液变红;再取少量溶液,加入BaCl2溶液产生白色沉淀,说明含有H2SO4.或取反应后的产物直接加BCl2溶液,有白色沉淀,再滴加紫色石蕊试液变红,说明含有H2SO4.
有关物质的部分性质如表:
| 物质 | 熔点/℃ | 沸点/℃ | 其它性质 |
| SO2Cl2 | -54.1 | 69.1 | ①易与水反应,产生大量白雾 ②易分解:SO2Cl2$\frac{\underline{\;100℃\;}}{\;}$SO2↑+Cl2↑ |
| H2SO4 | 10.4 | 338 | 吸水性且不易分解 |

(1)仪器A冷却水的进口为a(填“a”或“b”).
(2)仪器B中盛放的药品是碱石灰.
(3)实验所需二氧化硫用亚硫酸钠与硫酸制备,该反应的离子方程式为SO32-+2H+=SO2↑+H2O,以下与二氧化硫有关的说法中正确的是BE.
A.因为SO2具有漂白性,所以它能使品红溶液、溴水、酸性KMnO4溶液、石蕊试液褪色
B.能使品红溶液褪色的物质不一定是SO2
C.SO2、漂白粉、活性炭、Na2O2都能使红墨水褪色,且原理相同
D.等物质的量的SO2和Cl2混合后通入装有湿润的有色布条的集气瓶中,漂白效果更好
E.可用浓硫酸干燥SO2
F.可用澄清的石灰水鉴别SO2和CO2
(4)装置丙所盛试剂为除去Cl2中的HCl,若缺少装置乙,则硫酰氯会损失,该反应的化学方程式为SO2Cl2+2H2O═H2SO4+2HCl.
(5)少量硫酰氯也可用氯磺酸(ClSO3H)分解获得,该反应的化学方程式为:2ClSO3H═H2SO4+SO2Cl2,此方法得到的产品中会混有硫酸.
①从分解产物中分离出硫酰氯的方法是蒸馏.
②请设计实验方案检验产品中有硫酸(可选试剂:稀盐酸、稀硝酸、BaCl2溶液、蒸馏水、石蕊溶液):取产物在干燥条件下加热至完全反应(或挥发或分解等),冷却后加水稀释;取少量溶液滴加紫色石蕊试液变红;再取少量溶液,加入BaCl2溶液产生白色沉淀,说明含有H2SO4.或取反应后的产物直接加BCl2溶液,有白色沉淀,再滴加紫色石蕊试液变红,说明含有H2SO4.
3.下列物质属于醇类的是( )
| A. |  | B. |  | C. |  | D. |  |