题目内容
已知三氯化铁的熔点为306℃,沸点为315℃,易溶于水并且有强烈的吸水性,能吸收空气里的水分而潮解.某学习小组的同学对氯气与铁的反应及产物做了如下探究实验:

(1)装置的连接顺序为 .
(2)饱和食盐水的作用是 .
(3)反应一段时间后熄灭酒精灯,冷却后将硬质玻璃管及收集器中的物质一并快速转移至锥形瓶中,加入过量的稀盐酸和少许植物油(反应过程中不振荡),充分反应后,进行如下实验:

①淡黄色溶液中加入试剂X生成淡红色溶液的离子反应方程式为 .
②淡红色溶液中加入过量H2O2后溶液红色加深的原因是 .
(4)已知红色褪去的同时有气体生成,经检验为O2.该小组同学对红色褪去的原因进行探究.
①取褪色后溶液三份,第一份滴加FeCl3溶液无明显变化;第二份滴加试剂X,溶液出现红色;第三份滴加稀HCl和BaCl2溶液,产生白色沉淀.
②另取同浓度的 FeCl3溶液滴加2滴试剂X,溶液变红,再通入O2,无明显变化.
实验①说明 ;实验 ②的目的是 ;得出结论:溶液褪色的原因是 .

(1)装置的连接顺序为
(2)饱和食盐水的作用是
(3)反应一段时间后熄灭酒精灯,冷却后将硬质玻璃管及收集器中的物质一并快速转移至锥形瓶中,加入过量的稀盐酸和少许植物油(反应过程中不振荡),充分反应后,进行如下实验:

①淡黄色溶液中加入试剂X生成淡红色溶液的离子反应方程式为
②淡红色溶液中加入过量H2O2后溶液红色加深的原因是
(4)已知红色褪去的同时有气体生成,经检验为O2.该小组同学对红色褪去的原因进行探究.
①取褪色后溶液三份,第一份滴加FeCl3溶液无明显变化;第二份滴加试剂X,溶液出现红色;第三份滴加稀HCl和BaCl2溶液,产生白色沉淀.
②另取同浓度的 FeCl3溶液滴加2滴试剂X,溶液变红,再通入O2,无明显变化.
实验①说明
考点:探究物质的组成或测量物质的含量
专题:
分析:(1)排列顺序为气体的制取→洗气→干燥→氯气和铁的反应→尾气处理;
(2)饱和食盐水吸收氯化氢而抑制氯气溶解;
(3)①根据Fe3+和KSCN反应生成络合物硫氰化铁而使溶液呈血红色;
②Fe2+被H2O2氧化生成Fe3+,从而增大Fe3+浓度;
(4)根据①滴加FeCl3溶液无明显变化,说明SCN-发生了反应而不是Fe3+发生反应,滴加稀HCl和BaCl2溶液,产生白色沉淀,说明生成了硫酸根;
根据②另取同浓度的 FeCl3溶液滴加2滴试剂X,溶液变红,再通入O2,无明显变化,说明O2不能氧化SCN-.
(2)饱和食盐水吸收氯化氢而抑制氯气溶解;
(3)①根据Fe3+和KSCN反应生成络合物硫氰化铁而使溶液呈血红色;
②Fe2+被H2O2氧化生成Fe3+,从而增大Fe3+浓度;
(4)根据①滴加FeCl3溶液无明显变化,说明SCN-发生了反应而不是Fe3+发生反应,滴加稀HCl和BaCl2溶液,产生白色沉淀,说明生成了硫酸根;
根据②另取同浓度的 FeCl3溶液滴加2滴试剂X,溶液变红,再通入O2,无明显变化,说明O2不能氧化SCN-.
解答:
解:(1)浓硫酸具有吸水性能作氯气干燥剂、碱石灰具有碱性而吸收氯气、饱和食盐水吸收氯化氢而抑制氯气溶解,装置排列顺序为气体的制取→洗气→干燥→氯气和铁的反应→尾气处理,所以装置连接顺序为a→g→h→d→e→b→c→f,故答案为:a、g、h、d、e、b、c、f;
(2)饱和食盐水吸收氯化氢而抑制氯气溶解,故答案为:除去氯气中的氯化氢气体;
(3)①Fe3+和KSCN反应生成络合物硫氰化铁而使溶液呈血红色,反应方程式为Fe3++3SCN-?Fe(SCN)3;故答案为:Fe3++3SCN-?Fe(SCN)3;
②Fe2+被H2O2氧化生成Fe3+,从而增大Fe3+浓度,Fe3+、SCN-反应生成Fe(SCN)3,从而增大络合物浓度,溶液颜色加深,故答案为:Fe2+被H2O2氧化生成Fe3+,从而增大Fe3+浓度,Fe3+、SCN-反应生成Fe(SCN)3,从而增大络合物浓度;
(4)根据①滴加FeCl3溶液无明显变化,说明SCN-发生了反应而不是Fe3+发生反应,滴加稀HCl和BaCl2溶液,产生白色沉淀,说明生成了硫酸根;
根据②另取同浓度的 FeCl3溶液滴加2滴试剂X,溶液变红,再通入O2,无明显变化,说明O2不能氧化SCN-,所以氧化SCN-的为双氧水;
故答案为:SCN-发生了反应而不是Fe3+发生反应;排除H2O2分解产生的O2氧化SCN-的可能;H2O2将SCN-氧化成SO42-.
(2)饱和食盐水吸收氯化氢而抑制氯气溶解,故答案为:除去氯气中的氯化氢气体;
(3)①Fe3+和KSCN反应生成络合物硫氰化铁而使溶液呈血红色,反应方程式为Fe3++3SCN-?Fe(SCN)3;故答案为:Fe3++3SCN-?Fe(SCN)3;
②Fe2+被H2O2氧化生成Fe3+,从而增大Fe3+浓度,Fe3+、SCN-反应生成Fe(SCN)3,从而增大络合物浓度,溶液颜色加深,故答案为:Fe2+被H2O2氧化生成Fe3+,从而增大Fe3+浓度,Fe3+、SCN-反应生成Fe(SCN)3,从而增大络合物浓度;
(4)根据①滴加FeCl3溶液无明显变化,说明SCN-发生了反应而不是Fe3+发生反应,滴加稀HCl和BaCl2溶液,产生白色沉淀,说明生成了硫酸根;
根据②另取同浓度的 FeCl3溶液滴加2滴试剂X,溶液变红,再通入O2,无明显变化,说明O2不能氧化SCN-,所以氧化SCN-的为双氧水;
故答案为:SCN-发生了反应而不是Fe3+发生反应;排除H2O2分解产生的O2氧化SCN-的可能;H2O2将SCN-氧化成SO42-.
点评:本题通过探究氯气与铁反应,考查了物质性质实验方案的设计方法,题目难度稍大,注意掌握氯气与铁反应的现象、反应原理,明确物质性质实验方案的设计原则,试题充分考查了学生的分析、理解能力及化学实验能力.

练习册系列答案
 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案
相关题目
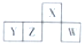 短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,且4种元素最外层电子数之和与Ca2+的核外电子数相等.下列判断正确的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,且4种元素最外层电子数之和与Ca2+的核外电子数相等.下列判断正确的是( )| A、元素X、Z的原子半径大小:X>Z |
| B、含Y元素的盐溶液有的显酸性,有的显碱性 |
| C、Y、W的简单氢化物中氢元素的化合价相同 |
| D、钙与W可以形成CaW2化合物,且化合物中含有离子键 |
室温下,下列溶液中粒子浓度大小关系正确的是( )
| A、浓度均为0l mol.L-1 的NaOH和NH4Cl 等体积混合后:c(Na+)=c(Cl-)>c(OH-)>c(NH4+) |
| B、0.1mol.L-1Na2S溶液中:c(Na+)=2c(S2-)+c(HS-)+c(H2S) |
| C、在pH<7的CH3COOH和CH3COONa的混合液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| D、pH=3的NaHSO3稀溶液中:c(Na+)>c(HSO3-)>c(H2SO3)>c(SO32-) |
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A、1.0 mol?L-1 KNO3溶液:H+、Fe2+、Cl-、SO42- |
| B、能溶解Al2O3的溶液:Na+、K+、Cl-、SiO32- |
| C、无色透明溶液中:Al3+、Cu2+、Cl-、HCO3- |
| D、使甲基橙变红色的溶液:Mg2+、K+、Cl-、SO42- |
化学与生产和生活、军事、科研产品紧密相关,下列说法错误的是( )
| A、家庭用的“84”消毒液与洁厕灵不能同时混合使用,否则会发生中毒事故 |
| B、在牙膏中添入Na2PO3F、NaF能防治龋齿,当提供的氟离子浓度相等时,它们防治龋齿的作用是相同的 |
| C、侯氏制碱法的工艺过程中主要应用了物质熔沸点的差异 |
| D、可用蘸浓盐酸的玻璃棒检验输送氨气的管道是否漏气 |
设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A、1 mol[Cu(NH3)4]2+ 中含有σ键的数目为12NA |
| B、0.1mol铁粉与足量水蒸气反应生成的H2分子数目为0.1NA |
| C、分子数目为0.1NA的N2和NH3混合气体,原子间含有的共用电子对数目为0.3NA |
| D、用惰性电极电解CuSO4溶液一段时间后,若加入0.05mol的Cu2(OH)2CO3固体恰好能使溶液恢复到原来的浓度,则该电解过程中转移电子的数目为0.2NA |
 ,经测定,C谱有四个峰,其数值高低比例为2:1:1:1;H谱有四个峰,其数值高低比例为1:2:3:6,有机物A碳谱有两个峰,峰高比为4:1,氢谱有一个峰,试写出有机物A的结构简式
,经测定,C谱有四个峰,其数值高低比例为2:1:1:1;H谱有四个峰,其数值高低比例为1:2:3:6,有机物A碳谱有两个峰,峰高比为4:1,氢谱有一个峰,试写出有机物A的结构简式 (1)向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液,下列对此现象的说法正确的是
(1)向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液,下列对此现象的说法正确的是