题目内容
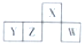 短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,且4种元素最外层电子数之和与Ca2+的核外电子数相等.下列判断正确的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,且4种元素最外层电子数之和与Ca2+的核外电子数相等.下列判断正确的是( )| A、元素X、Z的原子半径大小:X>Z |
| B、含Y元素的盐溶液有的显酸性,有的显碱性 |
| C、Y、W的简单氢化物中氢元素的化合价相同 |
| D、钙与W可以形成CaW2化合物,且化合物中含有离子键 |
考点:原子结构与元素周期律的关系
专题:元素周期律与元素周期表专题
分析:X、Y、Z、W四种属于短周期元素,根据元素在周期表中的位置知,X属于第二周期元素,Y、Z、W属于第三周期元素,设X的原子最外层电子数是a,则W的最外层电子数是a+1,Y的最外层电子数是a-2,Z最外层电子数是a-1,Ca2+的核外电子数为18,这四种元素原子的最外层电子数之和为18,则a-1+a+a+1+a-2=18,a=5,所以X是N元素、Y是Al元素、Z是Si元素、W是S元素,结合原子结构和性质解答该题.
解答:
解:X、Y、Z、W四种属于短周期元素,根据元素在周期表中的位置知,X属于第二周期元素,Y、Z、W属于第三周期元素,设X的原子最外层电子数是a,则W的最外层电子数是a+1,Y的最外层电子数是a-2,Z最外层电子数是a-1,Ca2+的核外电子数为18,这四种元素原子的最外层电子数之和为18,则a-1+a+a+1+a-2=18,a=5,所以X是N元素、Y是Al元素、Z是Si元素、W是S元素,
A.Z比X多一个电子层,Z的原子半径大,故A错误;
B.Y是Al元素,对应的盐溶液如为AlCl3等,则呈酸性,如为NaAlO2等,则呈碱性,故B正确;
C.Y、W的简单氢化物分别为AlH3、H2S,氢元素的化合价分别为-1价、+1价,故C错误;
D.W是S元素,与Ca反应生成CaS,不能生成CaS2,故D错误.
故选B.
A.Z比X多一个电子层,Z的原子半径大,故A错误;
B.Y是Al元素,对应的盐溶液如为AlCl3等,则呈酸性,如为NaAlO2等,则呈碱性,故B正确;
C.Y、W的简单氢化物分别为AlH3、H2S,氢元素的化合价分别为-1价、+1价,故C错误;
D.W是S元素,与Ca反应生成CaS,不能生成CaS2,故D错误.
故选B.
点评:本题考查了位置结构性质的相互关系及应用,为高频考点,侧重于学生的分析能力的考查,熟悉元素周期表结构及原子结构是解本题关键,结合元素周期律来分析解答,易错选项是D,难度中等.

练习册系列答案
相关题目
一种三室微生物燃料电池可用于污水净化、海水淡化,其工作原理如右图所示.以下说法不正确的是( )


| A、中间室Cl-移向左室 |
| B、X气体为CO2 |
| C、处理后的含硝酸根废水pH降低 |
| D、电路中每通过1 mol电子,产生标准状况下氮气的体积为2.24L |
如图实验装置一般不用于分离物质的是( )
A、 |
B、 |
C、 |
D、 |
单质或化合物A可能为Na、C、Si、N2、H2S,可以实现下列转化关系的有( )


| A、2种 | B、3种 | C、4种 | D、5种 |
关于下列各实验的叙述中,不正确的是( )

| A、图①可用于实验室制备少量氯气或氨气 |
| B、可从a处加水的方法检验设置装置②的气密性 |
| C、实验室可用装置③收集HCl气体 |
| D、装置④可用苯萃取碘水中碘的操作,并把苯的碘溶液从漏斗上口倒出 |

