题目内容
7.已知CH3COOH酸性强于HCN,一定温度下,等体积、等物质的量浓度为CH3COONa和NaCN两溶液中阴离子的总物质的量分别为n1和n2,则n1和n2的关系为n1>n2(填“>”、“<”或“=”).分析 HCN的酸性比CH3COOH的酸性弱,由越弱越水解知,醋酸钠的水解程度小于氢氰酸钠的水解程度,CN-+H2O?HCN+OH-,CH3COO-+H2O?CH3COOH+OH-,结合溶液中电荷守恒分析判断.
解答 解:HCN的酸性比CH3COOH的酸性弱,由越弱越水解知,醋酸钠的水解程度小于氢氰酸钠的水解程度,CN-+H2O?HCN+OH-,CH3COO-+H2O?CH3COOH+OH-,CH3COONa溶液中c(Na+)+c(H+)=c(CH3COO-)+c(OH-),NaCN溶液中c(Na+)+c(H+)=c(CN-)+c(OH-),钠离子的浓度不变且相等,CN-的水解程度较大,溶液中OH-的浓度较大,H+的浓度较小,故阳离子的浓度之和较小,则CH3COONa溶液中阴离子的总物质的量大于NaCN,即:n1>n2,
故答案为:>.
点评 本题考查了离子浓度大小比较,题目难度中等,明确溶液酸碱性与水解程度大小,注意掌握电荷守恒应用方法,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
12.常温下把铁片投入下列溶液中,铁片被溶解,溶液的质量增加但没有气体产生的是( )
| A. | 硫酸铁溶液 | B. | 浓硝酸 | C. | 盐酸 | D. | 硫酸铜溶液 |
2.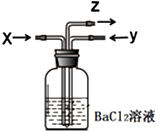 碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图),下列说法正确的是( )
碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图),下列说法正确的是( )
 碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图),下列说法正确的是( )
碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图),下列说法正确的是( )| A. | 洗气瓶中产生的沉淀是BaCO3 | B. | Z导管出来的气体中无CO2 | ||
| C. | 洗气瓶中产生的沉淀只有BaSO4 | D. | 洗气瓶中产生的沉淀可能有BaSO3 |
19.短周期元素M、W、X、Y、Z的原子序数依次增大,且M、W、X、Y+、Z2-的电子数与其电子层数的比值依次为1、3、4、5、6(不考虑零族元素).下列关于这些元素的叙述正确的是( )
| A. | X分别和其它四种元素均可形成至少2种化合物 | |
| B. | X、Y、Z离子半径依次增大 | |
| C. | Y和Z形成的简单离子都会破坏水的电离 | |
| D. | W、X、Z对应气态氢化物稳定性依次增强 |
16.下列物质属于电解质的是( )
| A. | 氯化钠 | B. | 铜 | C. | 氢氧化钠溶液 | D. | 乙醇 |
 ,为了研究X的结构,将化合物A在一定条件下水解只得到B(分子式为C8H8O3)和C(分子式为C7H6O3).C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生.
,为了研究X的结构,将化合物A在一定条件下水解只得到B(分子式为C8H8O3)和C(分子式为C7H6O3).C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生. .
. (其中两种).
(其中两种). 为主要原料制备
为主要原料制备 的合成路线流程图(无机试剂任选).合成路线流程图示例如下:
的合成路线流程图(无机试剂任选).合成路线流程图示例如下: .
.