题目内容
1.汽车常装有安全气囊,当发生强烈碰撞时,瞬间引发以下反应:2NaN3=2Na+3N2↑,所产生的气体快速充满气囊,可以达到保护车内人员的目的.(1)若气囊中装有130g NaN3,则其物质的量是2mol.
(2)若130g NaN3完全分解,在标准状况下,气囊膨胀的体积约为67.2L.
(3)该反应中的氧化剂是NaN3,氧化产物是N2.
分析 (1)根据n=$\frac{m}{M}$计算130gNaN3的物质的量;
(2)根据方程式计算生成氮气的物质的量,再根据V=nVm计算氮气的体积;
(3)氧化还原反应中,所含元素化合价降低的反应物为氧化剂,对应还原产物,所含元素化合价升高的反应物为还原剂,对应氧化产物.
解答 解:(1)130gNaN3的物质的量=$\frac{130g}{65g/mol}$=2mol,故答案为:2mol;
(2)设生成氮气的物质的量为n,则:
2NaN3=2Na+3N2↑
2 3
2mol n
n=3mol
故标况下生成氮气的体积=3mol×22.4L/mol=67.2L,故答案为:67.2L;
(3)2NaN3=2Na+3N2↑,反应物NaN3中氮元素化合价升高,Na元素化合价降低,所以NaN3既是氧化剂又是还原剂,钠为还原产物,N2为氧化产物;
故答案为:NaN3;N2.
点评 本题考查物质的量计算、化学方程式计算,氧化还原反应基本概念的判断,比较基础,侧重对基础知识的巩固,题目难度不大.

练习册系列答案
 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案
相关题目
17.能正确表示下列反应的离子方程式是( )
| A. | Ba(OH)2与MgSO4反应:Mg2++2OH-=Mg(OH)2↓ | |
| B. | 盐酸滴在石灰石上:CO32-+2H+═CO2↑+H2O | |
| C. | 硫酸铝溶液与氯化钡溶液混合:Ba2++SO42-═BaSO4↓ | |
| D. | 碳酸钙溶于稀醋酸中:CaCO3+2H+═Ca2++H2O+CO2↑ |
12.工业上制备硝酸的一个重要反应为:4NH3+5O2$\frac{\underline{催化剂}}{△}$ 4NO+6H2O.下列有关该反应的说法正确的是( )
| A. | O2是还原剂 | B. | NH3是氧化剂 | C. | O2失去电子 | D. | NH3发生氧化反应 |
9.下列关于电解法精炼粗铜的叙述中不正确的是( )
| A. | 粗铜板作阳极,纯铜片作阴极,CuSO4溶液作电解液 | |
| B. | 电解时,阳极发生氧化反应,而阴极发生的反应为:Cu2++2e-═Cu | |
| C. | 粗铜中所含Ni、Fe、Zn等金属杂质,电解后以单质形式沉积槽底,形成阳极泥 | |
| D. | 电解铜的纯度可达99.95%~99.98% |
16.下列说法中正确的是(NA表示阿伏加德罗常数的值)( )
| A. | 常温下,56g Fe与足量的浓硝酸反应,转移的电子数为3 NA | |
| B. | 标准状况下,含4molHCl的浓盐酸与足量MnO2反应可生成22.4LCl2 | |
| C. | 6.4 g铜在硫蒸气中完全燃烧生成硫化亚铜,转移的电子数为0.2NA | |
| D. | 常温常压下,0.1 mol氖气含有的电子数为NA |
6.有关实验操作,下列说法中正确的是( )
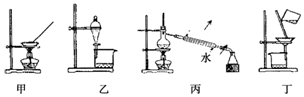

| A. | 甲装置可用于灼烧胆矾,制备无水硫酸铜 | |
| B. | 乙装置可用于分离溴单质与四氯化碳 | |
| C. | 丙装置可用于蒸馏,分离乙醇和水 | |
| D. | 丁装置可用于过滤,分离汽油和水的混合物 |
13.常温下,对于①0.1mol•L-1CH3COONa溶液,②pH=13的NaOH溶液,③pH=1的HC1溶液,
④0.1mol•L-1CH3COOH溶液,[已知Ka(CH3COOH)=1.75×10-5]下列说法正确的是( )
④0.1mol•L-1CH3COOH溶液,[已知Ka(CH3COOH)=1.75×10-5]下列说法正确的是( )
| A. | 水电离出的c(OH-):①>②>④>③ | |
| B. | ①和③混合后溶液呈中性:c(Na+)+c(H+)>c(CH3COO-)+c(Cl-) | |
| C. | ①和④混合后溶液呈酸性:$\frac{c(N{a}^{+})}{c(C{H}_{3}CO{O}^{-})}$=1 | |
| D. | ③和④分别稀释100倍后的pH④<③ |
10.食品的主要成分大都是有机化合物.下列食品中的有机成分不属于高分子化合物的是( )
| A. | 肥肉中的油脂 | B. | 谷类中的淀粉 | C. | 蔬菜中的纤维素 | D. | 瘦肉中的蛋白质 |