题目内容
4.下列离子方程式书写不正确的是( )| A. | AlCl3溶液与烧碱溶液反应,当n(OH-):n(Al3+)=7:2时,2Al3++7OH-=Al(OH)3↓+AlO2-+2H2O | |
| B. | 向饱和Na2CO3溶液中通入过量的CO2:CO32-+CO2+H2O=2HCO3- | |
| C. | CuCl2溶液与NaHS溶液反应,当n(CuCl2):n(NaHS)=1:2时,Cu2++2HS-=CuS↓+H2S↑ | |
| D. | Fe与稀硝酸反应,当n(Fe):n(HNO3)=1:2时,3Fe+2NO3-+8H+=3Fe2++2NO↑+4H2O |
分析 A.AlCl3溶液与氢氧化钠反应,按照1:3反应生成氢氧化铝沉淀,按照1:4反应生成偏铝酸钠,当n(OH-):n(Al3+)=7:2时,反应生成产物为氢氧化铝和偏铝酸钠;
B.二者反应生成碳酸氢钠,碳酸氢钠溶解性小于碳酸钠,所以会有晶体析出;
C.CuCl2溶液与NaHS溶液反应,当n(CuCl2):n(NaHS)=1:2时,生成硫化铜和硫化氢;
D.Fe与稀硝酸反应,当n(Fe):n(HNO3)=1:1时,硝酸不足反应生成硝酸亚铁;
解答 解:A.AlCl3溶液与氢氧化钠反应,按照1:3反应生成氢氧化铝沉淀,按照1:4反应生成偏铝酸钠,当n(OH-):n(Al3+)=7:2时,反应生成产物为氢氧化铝和偏铝酸钠,离子方程式:2Al3++7OH-=Al(OH)3↓+AlO2-+2H2O,故A正确;
B.二者反应生成碳酸氢钠,碳酸氢钠溶解性小于碳酸钠,所以会有晶体析出,离子方程式为2Na++CO32-+CO2+H2O=2NaHCO3↓,故B错误;
C.CuCl2溶液与NaHS溶液反应,当n(CuCl2):n(NaHS)=1:2时,离子方程式:Cu2++2HS-=CuS↓+H2S↑,故C正确;
D.Fe与稀硝酸反应,当n(Fe):n(HNO3)=1:2时,离子方程式:3Fe+2NO3-+8H+=3Fe2++2NO↑+4H2O,故D正确;
故选:B.
点评 本题考查了离子方程式的书写,侧重考查反应物用量对反应的隐形,明确反应实质是解题关键,题目难度中等.

练习册系列答案
相关题目
15.把下列四种碳酸氢钠溶液分别加入四个盛有10mL 2mol•L-1盐酸的烧杯中,均加水稀释到50mL,此时碳酸氢钠和盐酸反应,其中反应开始时速率最大的是( )
| A. | 10℃20 mL 3 mol•L-1的碳酸氢钠溶液 | |
| B. | 20℃20 mL 2 mol•L-1的碳酸氢钠溶液 | |
| C. | 20℃20 mL 4 mol•L-1的碳酸氢钠溶液 | |
| D. | 10℃20 mL 2 mol•L-1的碳酸氢钠溶液 |
12.工业上制备硝酸的一个重要反应为:4NH3+5O2$\frac{\underline{催化剂}}{△}$ 4NO+6H2O.下列有关该反应的说法正确的是( )
| A. | O2是还原剂 | B. | NH3是氧化剂 | C. | O2失去电子 | D. | NH3发生氧化反应 |
19.对于反应3Cl2+6NaOH=5NaCl+NaClO3+3H2O,以下叙述正确的是( )
| A. | Cl2是氧化剂,NaOH是还原剂 | |
| B. | 每生成1个的NaClO3转移10个的电子 | |
| C. | Cl2既是氧化剂又是还原剂 | |
| D. | 被氧化的Cl原子和被还原的Cl原子之比为5:1 |
9.下列关于电解法精炼粗铜的叙述中不正确的是( )
| A. | 粗铜板作阳极,纯铜片作阴极,CuSO4溶液作电解液 | |
| B. | 电解时,阳极发生氧化反应,而阴极发生的反应为:Cu2++2e-═Cu | |
| C. | 粗铜中所含Ni、Fe、Zn等金属杂质,电解后以单质形式沉积槽底,形成阳极泥 | |
| D. | 电解铜的纯度可达99.95%~99.98% |
16.下列说法中正确的是(NA表示阿伏加德罗常数的值)( )
| A. | 常温下,56g Fe与足量的浓硝酸反应,转移的电子数为3 NA | |
| B. | 标准状况下,含4molHCl的浓盐酸与足量MnO2反应可生成22.4LCl2 | |
| C. | 6.4 g铜在硫蒸气中完全燃烧生成硫化亚铜,转移的电子数为0.2NA | |
| D. | 常温常压下,0.1 mol氖气含有的电子数为NA |
13.常温下,对于①0.1mol•L-1CH3COONa溶液,②pH=13的NaOH溶液,③pH=1的HC1溶液,
④0.1mol•L-1CH3COOH溶液,[已知Ka(CH3COOH)=1.75×10-5]下列说法正确的是( )
④0.1mol•L-1CH3COOH溶液,[已知Ka(CH3COOH)=1.75×10-5]下列说法正确的是( )
| A. | 水电离出的c(OH-):①>②>④>③ | |
| B. | ①和③混合后溶液呈中性:c(Na+)+c(H+)>c(CH3COO-)+c(Cl-) | |
| C. | ①和④混合后溶液呈酸性:$\frac{c(N{a}^{+})}{c(C{H}_{3}CO{O}^{-})}$=1 | |
| D. | ③和④分别稀释100倍后的pH④<③ |
14.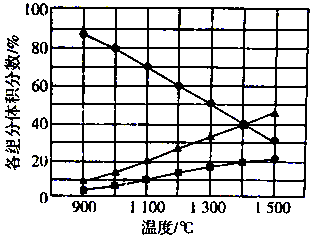 H2S在高温下分解生成硫蒸气(S2)和H2,不同温度下,反应体系中各组分的体积分数如图所示.则1400℃时反应体系中混合气体的平均摩尔质量为( )
H2S在高温下分解生成硫蒸气(S2)和H2,不同温度下,反应体系中各组分的体积分数如图所示.则1400℃时反应体系中混合气体的平均摩尔质量为( )
 H2S在高温下分解生成硫蒸气(S2)和H2,不同温度下,反应体系中各组分的体积分数如图所示.则1400℃时反应体系中混合气体的平均摩尔质量为( )
H2S在高温下分解生成硫蒸气(S2)和H2,不同温度下,反应体系中各组分的体积分数如图所示.则1400℃时反应体系中混合气体的平均摩尔质量为( )| A. | 20.8g/mol | B. | 27.2 g/mol | C. | 33.3 g/mol | D. | 39.6 g/mol |
 ,该元素属于非金属元素(填“金属”或“非金属”).
,该元素属于非金属元素(填“金属”或“非金属”).