题目内容
15.设NA表示阿伏加德罗常数的值,下列说法正确的是( )| A. | 1.2 g NaHSO4晶体中阳离子和阴离子的总数为0.03 NA | |
| B. | 25℃时,1L pH=1的硫酸溶液中,含有H+的数目为0.2NA | |
| C. | 2mol SO2与足量氧气在适当的条件下反应生成SO3,转移的电子数为4NA | |
| D. | 含1mol Cl-的NH4Cl溶液中加入适量氨水使溶液呈中性,此时溶液中NH4+数为NA |
分析 A、求出硫酸氢钠的物质的量,然后根据1mol硫酸氢钠中含1mol钠离子和1mol硫酸氢根来分析;
B、pH=1的溶液中,氢离子浓度为0.1mol/L;
C、二氧化硫和氧气的反应为可逆反应;
D、溶液显中性,故溶液中的氢离子的物质的量和氢氧根的物质的量相同.
解答 解:A、1.2g硫酸氢钠的物质的量为0.01mol,而1mol硫酸氢钠中含1mol钠离子和1mol硫酸氢根,故含0.02NA个离子,故A错误;
B、pH=1的溶液中,氢离子浓度为0.1mol/L,故溶液中含有的氢离子的个数为0.1NA个,故B错误;
C、二氧化硫和氧气的反应为可逆反应,故不能进行完全,则转移的电子数小于4NA个,故C错误;
D、溶液显中性,故溶液中的氢离子的物质的量和氢氧根的物质的量相同,而溶液显电中性,故有n(H+)+n(NH4+)=n(OH-)+n(Cl-),故有n(NH4+)=n(Cl-)=1mol,故为NA个,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
6.向盛有H2O2溶液的试管中滴入少量浓盐酸,经检验生成的混合气体中只含有O2、Cl2、HCl和水蒸气.将气体通入X溶液(如图),依据观察到的现象,能判断气体中含有Cl2的是( )
| X溶液 | 现象 |  | |
| A | 稀HNO3酸化的AgNO3溶液 | 有白色沉淀生成 | |
| B | 滴有KSCN的FeSO4溶液 | 溶液变为血红色 | |
| C | 淀粉KI酸性溶液 | 溶液变为蓝色 | |
| D | 紫色石蕊溶液 | 溶液先变红后褪色 |
| A. | A | B. | B | C. | C | D. | D |
10.下列解释实验事实的离子方程式正确的是( )
| A. | 硫酸亚铁在空气中被氧化:4Fe2++3O2+6H2O═4Fe(OH)3 | |
| B. | 向CH2Br-COOH中加入足量的NaOH溶液并加热:CH2Br-COOH+OH-$\stackrel{△}{→}$CH2Br-COO-+H2O | |
| C. | FeCl3溶液中通入SO2,溶液黄色褪去:2Fe3++SO2+2H2O═2Fe2++SO42-+4H+ | |
| D. | 碳酸钠溶液滴入酚酞变红:CO32-+2H2O?H2CO3+2OH- |
20.锶(Sr)元素广泛存在于矿泉水中,是一种人体必需的微量元素.用天青石(主要成分为SrSO4,含有少量BaCO3、FeO、Fe2O3、Al2O3、SiO2等)制备SrCO3,工艺流程如图1:
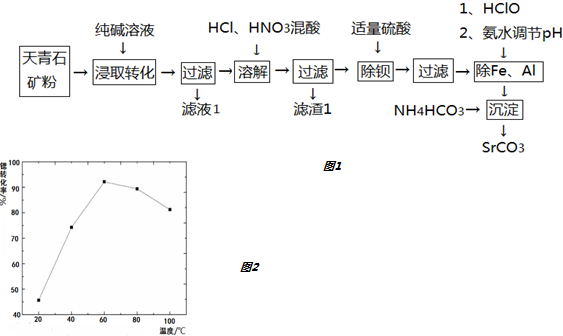
已知:
(1)“浸取转化”过程中发生的化学方程式为:SrSO4+Na2CO3=SrCO3+Na2SO4;当转化完全时,混合液中的c(CO32-)=1.0×10-3 mol•L-1,则c(SO42-)=2.0mol/L.
(2)滤液1的主要成分为Na2SO4或硫酸钠;滤渣1的主要成分为SiO2.
(3)“除钡”过程中硫酸不要过量,原因是硫酸过量后会生成SrSO4沉淀,降低产率.
(4)“沉淀”生成SrCO3的离子方程式为Sr2++2HCO3-=SrCO3↓+H2O+CO2↑.
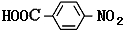
沉淀过程中,温度对Sr2+生成SrCO3反应转化率的影响见如图2,60℃之前,锶转化率随温度升高而变大的主要原因是升温有利于CO2的逸出
(5)以SrCO3粉作原料经高温焙烧分解成SrO,再将SrO与铝粉充分混合并压制,真空环境下通过热还原反应可制得金属Sr,同时获得3SrO•Al2O3渣团.请写出热还原反应的化学方程式6SrO+2Al$\frac{\underline{\;\;△\;\;}}{\;}$3Sr+3SrO•Al2O3.

已知:
| SrSO4 | BaSO4 | SrCO3 | |
| Ksp | 3.2×10-7 | 1.1×10-10 | 1.6×10-10 |
(2)滤液1的主要成分为Na2SO4或硫酸钠;滤渣1的主要成分为SiO2.
(3)“除钡”过程中硫酸不要过量,原因是硫酸过量后会生成SrSO4沉淀,降低产率.
(4)“沉淀”生成SrCO3的离子方程式为Sr2++2HCO3-=SrCO3↓+H2O+CO2↑.
沉淀过程中,温度对Sr2+生成SrCO3反应转化率的影响见如图2,60℃之前,锶转化率随温度升高而变大的主要原因是升温有利于CO2的逸出
(5)以SrCO3粉作原料经高温焙烧分解成SrO,再将SrO与铝粉充分混合并压制,真空环境下通过热还原反应可制得金属Sr,同时获得3SrO•Al2O3渣团.请写出热还原反应的化学方程式6SrO+2Al$\frac{\underline{\;\;△\;\;}}{\;}$3Sr+3SrO•Al2O3.
7.A、B、C、D、E五种元素分属于三个短周期,且原子序数依次增大.A、C同主族,可形成离子化合物CA;B、D同主族,且D的原子序数是B的2倍,则下列说法正确的是( )
| A. | B元素在周期表中的位置为第二周期ⅣA族 | |
| B. | D的氧化物和E的单质的水溶液均有漂白性,且漂白的原理相同 | |
| C. | 由A、B、C、D组成的两种盐的溶液反应可产生DB2气体 | |
| D. | 上述元素的非金属气态氢化物还原性最强的是E |

 .
.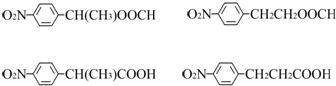 任意2种.
任意2种.
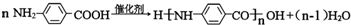 .
.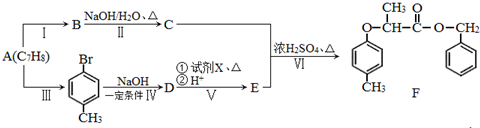

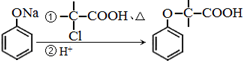
 +NaOH $→_{△}^{水}$
+NaOH $→_{△}^{水}$  +NaCl.
+NaCl. .
. 为原料制取
为原料制取 的合成路线图.
的合成路线图.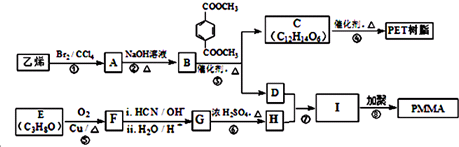
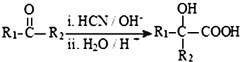 (R、R1、R2、R3均代表烃基)
(R、R1、R2、R3均代表烃基)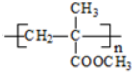 .
.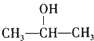 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2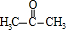 +2H2O.
+2H2O.