题目内容
6.向盛有H2O2溶液的试管中滴入少量浓盐酸,经检验生成的混合气体中只含有O2、Cl2、HCl和水蒸气.将气体通入X溶液(如图),依据观察到的现象,能判断气体中含有Cl2的是( )| X溶液 | 现象 |  | |
| A | 稀HNO3酸化的AgNO3溶液 | 有白色沉淀生成 | |
| B | 滴有KSCN的FeSO4溶液 | 溶液变为血红色 | |
| C | 淀粉KI酸性溶液 | 溶液变为蓝色 | |
| D | 紫色石蕊溶液 | 溶液先变红后褪色 |
| A. | A | B. | B | C. | C | D. | D |
分析 能判断气体中含有Cl2,氯气与水反应生成盐酸和HClO,具有酸性和漂白性,结合漂白性可检验,以此来解答.
解答 解:A.含HCl也可生成白色沉淀,不能判断是否含氯气,故A不选;
B.氧气可氧化亚铁离子,溶液变为红色,不能判断是否含氯气,故B不选;
C.氧气可氧化KI,溶液变蓝,不能判断是否含氯气,故C不选;
D.紫色石蕊溶液先变红后褪色,可知一定含氯气,氯气与水反应生成盐酸和HClO,具有酸性和漂白性,故D选;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质及发生的反应和现象、实验装置的作用为解答的关键,侧重分析与实验能力的考查,注意现象与结论的关系,注重元素化合物与实验相结合的训练,题目难度不大.

练习册系列答案
 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案
相关题目
16.在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应X(g)+Y(g)?2Z(g);△H<0,一段时间后达到平衡.反应过程中测定的数据如下表:
下列说法正确的是( )
| t/min | 2 | 4 | 7 | 9 |
| n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
| A. | 0~2 min的平均速率v(Z)=2.0×10-3 mol•L-1•min-1 | |
| B. | 其他条件不变,降低温度,反应达到新平衡前 v(正)<v(逆) | |
| C. | 该温度下此反应的平衡常数K=144 | |
| D. | 其他条件不变,再充入0.2 mol Z,平衡时X的体积分数不变 |
1.化学与人类生产、生活、环境保护及社会可持续发展密切相关,下列有关叙述正确的是( )
| A. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| B. | PM2.5表面积大,能吸附大量的有毒有害物质,对人的肺功能造成很大危害 | |
| C. | 光纤通信使用的光缆主要成分是Si,太阳能电池使用的材料主要是SiO2 | |
| D. | 汽车尾气中含有大量大气污染物,这是汽油不完全燃烧造成的 |
11.下列说法正确的是( )
| A. | 乙醛既具有氧化性也具有还原性 | |
| B. | 煤的气化和干馏原理相同 | |
| C. | 动物油加入稀硫酸生产肥皂 | |
| D. | 石油裂解和蔗糖水解都是由高分子生成小分子的过程 |
18.NA代表阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 9 g超重水(3H216O)含中子数为6NA | |
| B. | 标准状况下,22.4 L CCl4含有的分子数目为NA | |
| C. | 常温常压下,92g的NO2和N2O4混合气体含有的原子数为6NA | |
| D. | 一定条件下,将1 mol N2和3 mol H2混合,充分反应后转移的电子数为6NA |
15.设NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 1.2 g NaHSO4晶体中阳离子和阴离子的总数为0.03 NA | |
| B. | 25℃时,1L pH=1的硫酸溶液中,含有H+的数目为0.2NA | |
| C. | 2mol SO2与足量氧气在适当的条件下反应生成SO3,转移的电子数为4NA | |
| D. | 含1mol Cl-的NH4Cl溶液中加入适量氨水使溶液呈中性,此时溶液中NH4+数为NA |
 ,分子中非金属元素电负性由大到小的顺序为O、N、C、H.
,分子中非金属元素电负性由大到小的顺序为O、N、C、H.

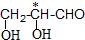 标有*号的碳原子(与其直接相连的4个原子或者原子团互不相同)为手性碳原子,由此把具有手性碳原子的分子称为手性分子.手性分子通常有两种构型,在生理活性等方面有很大的差别.请问青蒿素分子E中共有7个手性碳原子.
标有*号的碳原子(与其直接相连的4个原子或者原子团互不相同)为手性碳原子,由此把具有手性碳原子的分子称为手性分子.手性分子通常有两种构型,在生理活性等方面有很大的差别.请问青蒿素分子E中共有7个手性碳原子.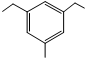 结构.有4种;写出其中一种的结构简式
结构.有4种;写出其中一种的结构简式 任意一种.
任意一种.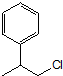 为原料合成
为原料合成 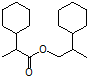 ,写出其合成路线(指明所用试剂和反应条件).
,写出其合成路线(指明所用试剂和反应条件).