题目内容
10.盐酸、硫酸是中学阶段常见的酸,请回答下列问题:(1)实验室常利用浓盐酸和二氧化锰在加热条件下反应制氯气,此过程中,浓盐酸所体现的性质是还原性和酸性.
(2)在一定体积的98%的浓硫酸(密度为1.84g•mL-1)中加入过量的铜片,并加热,充分反应后,被还原的硫酸是0.92mol,则该硫酸的实际体积A(选填字母).
A.大于100mL B.等于100L C.小于100mL D.无法判断
(3)稀盐酸与铜不反应,但将铜屑放入稀盐酸后不断通入02后,则可使铜溶解,该反应的离子方程式为2Cu+4H++O2=2Cu2++2H2O.
分析 (1)反应中HCl作还原剂,还表现酸性;
(2)根据c=$\frac{1000ρω}{M}$计算浓硫酸物质的量,根据Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+H2O,计算参加反应硫酸物质的量,根据V=$\frac{n}{c}$计算需要浓硫酸的理论体积,但Cu与浓硫酸反应,随反应的进行,浓硫酸变为稀硫酸,Cu与稀硫酸不反应;
(3)稀盐酸与铜与氧气反应生成氯化铜、和水.
解答 解:(1)浓盐酸和二氧化锰在加热条件下反应制氯气,反应中Cl元素的化合价升高被氧化,HCl作还原剂,反应中盐酸还表现酸性;
故答案为:还原性和酸性;
(2)密度1.84g•cm-3、质量分数为98%的浓硫酸的物质的量浓度为$\frac{1000×1.84×98%}{98}$mol/L=18.4mol/L,Cu与浓硫酸反应,随反应的进行,浓硫酸变为稀硫酸,Cu与稀硫酸不反应,所以被还原的硫酸为 0.9mol,由Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+H2O,可知参加反应硫酸为0.92mol×2=1.84mol,
则浓硫酸的实际体积应大于$\frac{1.84mol}{18.4mol/L}$=0.1L=100mL;
故答案为:A;
(3)稀盐酸与铜与氧气反应生成氯化铜、和水,其反应的离子方程式为:2Cu+4H++O2=2Cu2++2H2O;
故答案为:2Cu+4H++O2=2Cu2++2H2O.
点评 本题考查了硫酸的性质、盐酸的性质、物质的量的有关计算、离子方程式的书写等,题目难度不大,侧重于考查学生对基础知识的应用能力,注意把握浓硫酸与Cu反应时硫酸不能完全反应.

 阅读快车系列答案
阅读快车系列答案| A. | 无色溶液中:Na+、Cl-、SCN-、Fe3+ | |
| B. | 碱性溶液中:Na+、AlO2-、Cl-、SO42- | |
| C. | 加入铝粉后产生氢气的溶液中:Ba2+、K+、NO3-、Al3+ | |
| D. | 无色溶液中:Na+、HCO3-、Cl-、OH- |
| A. | 溶液褪色 | B. | 产生白色沉淀 | C. | 无明显现象 | D. | 产生黄色沉淀 |
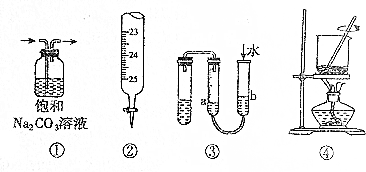
| A. | ①用于除去CO2中的SO2 | B. | ②用于量取20.00mL Na0H溶液 | ||
| C. | ③用于判断装置的气密性 | D. | ④用于将海带燃烧成灰 |
| 选项 | 改变条件 | 平衡移动方向 | 导电能力 |
| A | 加入蒸馏水 | 逆向移动 | 减弱 |
| B | 加入少量冰醋酸 | 正向移动 | 增强 |
| C | 加入少量CH3COONa固体 | 正向移动 | 增强 |
| D | 加入少量0.1mol•L-1的稀硫酸 | 逆向移动 | 减弱 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 某溶液与Na0H溶液共热.产生使湿润的石蕊试纸变红的气体,说明原溶液中存在NH${\;}_{4}^{+}$ | |
| B. | 某溶液中加人AgN03溶液时,产生白色沉淀.说明原溶液中含有Cl- | |
| C. | 用铂丝蘸取某溶液在酒精灯火焰上灼烧时,火焰呈黄色,说明原溶液中含有金属钠 | |
| D. | 某溶液中加人BaCl2溶液时,产生白色沉淀.原溶液中可能存在Ag+或SO42-或CO32- |

| A. | a与b比较,b使用了催化剂 | B. | a与b比较,b温度更高 | ||
| C. | a与b比较,b的压强更大 | D. | a与b比较,b反应速率更大 |
| 金属 | Na | Cu | Al | Fe |
| 熔点/℃ | 97.5 | 1 083 | 660 | 1 535 |
| 沸点/℃ | 883 | 2 595 | 2 200 | 3 000 |
| A. | Cu与Na | B. | Fe与Cu | C. | Fe与Al | D. | Al与Na |
 肼(H2N-NH2)是一种高能燃料,有关化学反应的能量变化如图所示,已知断裂1mol化学键所需的能量(kJ):N≡N为942、O=O为500、N-N为154,则
肼(H2N-NH2)是一种高能燃料,有关化学反应的能量变化如图所示,已知断裂1mol化学键所需的能量(kJ):N≡N为942、O=O为500、N-N为154,则