题目内容
20.已知有机物中一个碳原子上不能同时连2个羟基,1mol某醇与2mol乙酸反应,生成的有机物的分子式为C6H10O4,则该醇的结构简式为( )| A. | HOCH2CH2CH2OH | B. | CH3OH | C. | CH3CH2OH | D. | HOCH2CH2OH |
分析 1 mol某醇与2 mol乙酸反应,说明醇中含有2个羟基,根据酯化反应原理,1 mol某醇与2 mol乙酸反应生成二元酯的分子式为C6H10O4,同时生成2 mol H2O,根据原子守恒可以判断该醇中含有2个碳原子、6个氢原子、2个氧原子,又知一个碳原子上不能同时连2个羟基,所以该醇的结构简式为HOCH2CH2OH.
解答 解:1 mol某醇与2 mol乙酸反应,说明醇中含有2个羟基,根据酯化反应原理,1 mol某醇与2 mol乙酸反应生成二元酯的分子式为C6H10O4,同时生成2 mol H2O,根据原子守恒可以判断该醇中含有2个碳原子、6个氢原子、2个氧原子,又知一个碳原子上不能同时连2个羟基,所以该醇的结构简式为HOCH2CH2OH.
故选D.
点评 本题考查有机物结构简式的推断,为高频考点,把握有机物中含官能团的数目为解答的关键,侧重分析与推断能力的考查,题目难度中等.

练习册系列答案
相关题目
10.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 一定条件下,将1 mol N2和3 mol H2混合发生反应,转移的电子总数为6 NA | |
| B. | 1 L 0.1 mol•L-1的Na2CO3溶液中阴离子的总数大于0.1 NA | |
| C. | 标准状况下,44.8LHF中含有分子的数目为2NA | |
| D. | 1 mol-CH3中所含的电子总数为10 NA |
11.东晋葛洪在《抱朴子》中写道“扶南生金刚,生水底石上,如钟乳状,体似紫石英,可以刻玉,人没水取之,虽铁椎之亦不能伤.”文中所述“金刚”可能为( )
| A. | 结晶氯化钠 | B. | 金刚石 | C. | 碳酸钙 | D. | 二氧化硅 |
9.某温度时,在体积为2L的密闭容器中,气态物质A、B、E、F的物质量n随时间t的变化如图甲所示,在一定条件下达到平衡,反应进程中正反应速率随时间的倾谈情况如图乙所示,在t2、t4时刻分别只改一个条件(温度、压强或某反应物的量).下列说法错误的是( )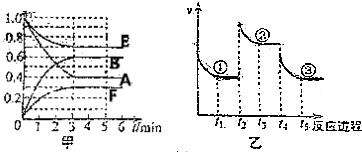

| A. | t2时刻可能是增大压强 | |
| B. | 平衡状态①和②,平衡常数K一定相同 | |
| C. | 平衡状态①、②和③中,状态③中F的浓度最大 | |
| D. | t4时刻改变的条件是降低温度 |
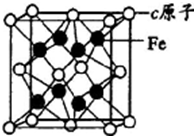
10. 有A、B、C、D四种含14个电子的粒子,其结构特点如下:
有A、B、C、D四种含14个电子的粒子,其结构特点如下:
(1)某元素的原子核外电子数比A元素原子核外电子数多2,则该元素在周期表中的位置为第三周期第VIA族.工业上常以焦炭、A元素的氧化物为原料制取单质A,用化学方程式表示其原理SiO2+2C $\frac{\underline{\;高温\;}}{\;}$ Si+2CO↑.
(2)在101kPa,25℃时,42g B完全燃烧放出424.5kJ的热量,写出表示B的燃烧热的热化学方程式:CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0 kJ/mol.
(3)32g 由D与钙离子组成的化合物中,含有的共用电子对数为9.03×1023.
(4)组成C的元素与另一短周期元素组成的分子的球棍模型如图所示.已知分子中所有原子的最外层均达到8电子稳定结构,原子间均以单键相连接.下列有关说法中错误的是C.
A.X原子为组成C的元素原子
B.该分子中,既含极性键,又含非极性键
C.Y原子可能为氢原子
D.从圆球的相对大小来分析,该分子可能为N2F4
(5)甲是组成C的元素最简单的气态氢化物.
①一定条件下,甲在恒容密闭容器中发生分解反应(正反应方向为吸热反应)并达平衡后,仅改变表中反应条件x,下列各项中y随x的增大而增大的是bc(填序号).
②甲与空气可以构成一种环保型燃料电池,电解质溶液是KOH,其负极的电极反应式为2NH3-6e-+6OH-=N2+6H2O.
 有A、B、C、D四种含14个电子的粒子,其结构特点如下:
有A、B、C、D四种含14个电子的粒子,其结构特点如下:| 粒子代码 | A | B | C | D |
| 原子核数目 | 单核 | 不同元素构成的两核 | 同种元素构成的两核 | 同种元素构成的两核 |
| 粒子所带电荷数 | 0 | 0 | 0 | 两个负电荷 |
(2)在101kPa,25℃时,42g B完全燃烧放出424.5kJ的热量,写出表示B的燃烧热的热化学方程式:CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0 kJ/mol.
(3)32g 由D与钙离子组成的化合物中,含有的共用电子对数为9.03×1023.
(4)组成C的元素与另一短周期元素组成的分子的球棍模型如图所示.已知分子中所有原子的最外层均达到8电子稳定结构,原子间均以单键相连接.下列有关说法中错误的是C.
A.X原子为组成C的元素原子
B.该分子中,既含极性键,又含非极性键
C.Y原子可能为氢原子
D.从圆球的相对大小来分析,该分子可能为N2F4
(5)甲是组成C的元素最简单的气态氢化物.
①一定条件下,甲在恒容密闭容器中发生分解反应(正反应方向为吸热反应)并达平衡后,仅改变表中反应条件x,下列各项中y随x的增大而增大的是bc(填序号).
| 选项 | a | b | c | d |
| x | 温度 | 温度 | 加入H2的物质的量 | 加入甲的物质的量 |
| y | 混合气体的平均相对分子质量 | 平衡常数K | 混合气体的密度 | 达平衡时的甲的转化率 |
 a、b、c、d是四种原子序数依次增大的短周期元素.a原子的电子层数为n,核内质子数是2n2-1,最外层电子数为2n+l;b、d同主族,能形成两种中学常见的化合物;c与b组成的化合物是一种两性氧化物,工业上通过电解该化合物可冶炼c单质;e原子有四个能层,其未成对电子数在同周期是最多的.回答下列问题:
a、b、c、d是四种原子序数依次增大的短周期元素.a原子的电子层数为n,核内质子数是2n2-1,最外层电子数为2n+l;b、d同主族,能形成两种中学常见的化合物;c与b组成的化合物是一种两性氧化物,工业上通过电解该化合物可冶炼c单质;e原子有四个能层,其未成对电子数在同周期是最多的.回答下列问题: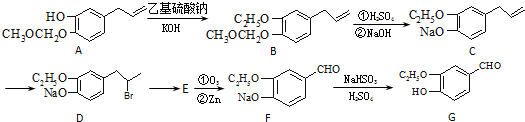
 .
.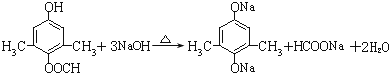
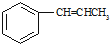 为原料制备
为原料制备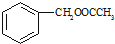 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下: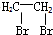
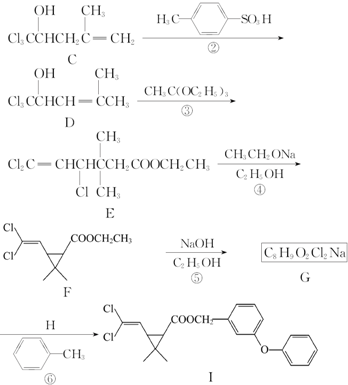
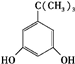 、
、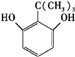 、
、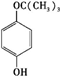 任意一种.
任意一种.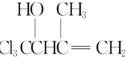 为原料合成
为原料合成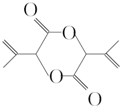 (用合成路线流程图表示,并注明反应条件).
(用合成路线流程图表示,并注明反应条件).
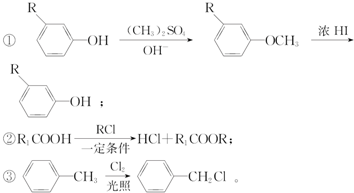
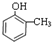 .
.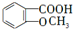 +
+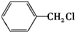 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$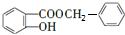 +HCl.
+HCl.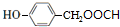 .
.