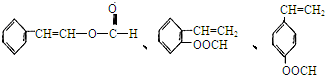题目内容
(1)碘是人体不可缺乏的元素,为了防止碘缺乏,现在市场上流行一种加碘盐,就是在精盐中添加一定量的KIO3进去.某研究小组为了检测某加碘盐中是否含有碘,查阅了有关的资料,发现其检测原理是:KIO3+5KI+3H2SO4=3I2+3H2O+3K2SO4.在实验时先取少量的加碘盐加蒸馏水溶解,然后加入稀硫酸和KI溶液,最后加入一定量的苯震荡.
①观察到的现象是 ;该实验中用苯做萃取剂的理由是 .
②若从含碘的有机溶液中提取碘和回收有机溶剂,还需经过 (填操作方法),利用这种方法,最后碘在 (填仪器名称)中聚集.
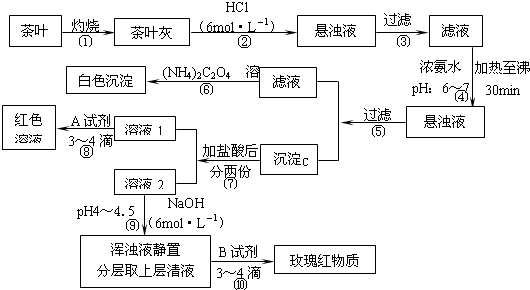
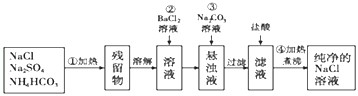
(2)若有一混有少量硫酸钠、碳酸氢铵的氯化钠样品,需要提纯得到氯化钠.某学生设计了如下方案:
请回答以下问题:
Ⅰ.操作①中用于盛放固体的仪器为 (写仪器名称).
Ⅱ.操作②是否可以改为加硝酸钡溶液?为什么? .
Ⅲ.进行操作②后,如何判断SO42-已除尽,方法是 .
Ⅳ.操作③的目的是 ,为什么不先过滤后加碳酸钠溶液?理由是 .
Ⅴ.操作④的目的是 .
①观察到的现象是
②若从含碘的有机溶液中提取碘和回收有机溶剂,还需经过
(2)若有一混有少量硫酸钠、碳酸氢铵的氯化钠样品,需要提纯得到氯化钠.某学生设计了如下方案:
请回答以下问题:
Ⅰ.操作①中用于盛放固体的仪器为
Ⅱ.操作②是否可以改为加硝酸钡溶液?为什么?
Ⅲ.进行操作②后,如何判断SO42-已除尽,方法是
Ⅳ.操作③的目的是
Ⅴ.操作④的目的是

考点:物质分离和提纯的方法和基本操作综合应用,物质分离、提纯的实验方案设计
专题:实验设计题
分析:(1)①苯与水不相溶,碘单质易溶于有机溶剂,加入苯溶液振荡后发生萃取现象;
②分离相互溶解的液体需要通过蒸馏方法,蒸馏操作需要在蒸馏烧瓶中进行;
(2)加热混合物,杂质碳酸氢铵通过分解而除去,得到氯化钠、硫酸钠的混合物;溶解后加入氯化钡溶液除去硫酸根离子,再加入过量碳酸钠除去过量的钡离子,过滤后向滤液中加入盐酸调节溶液pH除去过量的碳酸根离子,对滤液加热除去溶液中氯化氢和二氧化碳,最后得到纯净的氯化钠溶液,
Ⅰ.操作①将固体混合物加热,根据给固体加热常用仪器进行选择;
Ⅱ.除杂不能引入新的杂质,加入硝酸钡会引进难以除去的硝酸根离子;
Ⅲ.加入氯化钡溶液检验硫酸根离子是否除尽;
Ⅳ.加入碳酸钠溶液,除去过量的氯化钡互溶钙离子;过滤后加碳酸钠溶液会增加了过滤操作次数;
Ⅴ.盐酸和二氧化碳在加热煮沸的情况下可以挥发出来,不影响氯化钠的纯度.
②分离相互溶解的液体需要通过蒸馏方法,蒸馏操作需要在蒸馏烧瓶中进行;
(2)加热混合物,杂质碳酸氢铵通过分解而除去,得到氯化钠、硫酸钠的混合物;溶解后加入氯化钡溶液除去硫酸根离子,再加入过量碳酸钠除去过量的钡离子,过滤后向滤液中加入盐酸调节溶液pH除去过量的碳酸根离子,对滤液加热除去溶液中氯化氢和二氧化碳,最后得到纯净的氯化钠溶液,
Ⅰ.操作①将固体混合物加热,根据给固体加热常用仪器进行选择;
Ⅱ.除杂不能引入新的杂质,加入硝酸钡会引进难以除去的硝酸根离子;
Ⅲ.加入氯化钡溶液检验硫酸根离子是否除尽;
Ⅳ.加入碳酸钠溶液,除去过量的氯化钡互溶钙离子;过滤后加碳酸钠溶液会增加了过滤操作次数;
Ⅴ.盐酸和二氧化碳在加热煮沸的情况下可以挥发出来,不影响氯化钠的纯度.
解答:
解:(1)①碘易溶于有机溶剂,在苯中溶解度远大于在水中,加入苯后有机溶剂苯萃取水中的碘单质,苯与水不互溶,溶液分成两层,苯的密度比水小,有机层在上层,碘溶于苯呈紫色,下层层几乎无色,
故答案为:分层,上层紫色,下层为近于无色;苯与水互不相溶,碘在苯中的溶解度比在水中大;
②若从含碘的有机溶液中提取碘和回收有机溶剂,由于碘单质易溶于苯,可以利用其沸点不同,通过蒸馏操作完成;苯的沸点较低,所以蒸馏操作过程中,最后碘在蒸馏烧瓶中聚集,
故答案为:蒸馏;蒸馏烧瓶;
(2)提纯氯化钠的流程为:加热混合物,杂质碳酸氢铵通过分解而除去,得到氯化钠、硫酸钠的混合物;溶解后加入过量氯化钡溶液除去硫酸根离子,再加入过量碳酸钠除去过量的钡离子,过滤除去碳酸钡、硫酸钡沉淀后向滤液中加入盐酸,明确是调节溶液pH除去过量的碳酸根离子,对滤液加热除去溶液中氯化氢和二氧化碳,最后得到纯净的氯化钠溶液,
Ⅰ.根据图示,操作①是将固体混合物加热,使用到的仪器是坩埚,
故答案为:坩埚;
Ⅱ.加入硝酸钠溶液,硝酸钠和硫酸钠反应生成硫酸钡和硝酸钠,除去了硫酸钠,但引入了硝酸钠等新的杂质,
故答案为:不可以,改用Ba(NO3)2会使溶液中引入新的杂质离子NO3-,以后操作中无法除去;
Ⅲ.加入过量氯化钡溶液除去硫酸根离子,检验硫酸根离子已除尽,可静止片刻在上层清液处,滴加一滴氯化钡溶液,不出现浑浊就说明硫酸根离子已经除尽,
故答案为:取少量上层澄清溶液,再滴加BaCl2溶液,如无沉淀出现则说明SO42-已除尽(或其他的方法);
Ⅳ.操作③加入碳酸钠溶液,碳酸钠与过量的氯化钠反应生成碳酸钡和氯化钠,除去过量的氯化钡,再过滤;先过滤而后加碳酸钠溶液,在加入碳酸钠溶液后生成的碳酸钡还需要过滤,增加一次过滤操作;
故答案为:除去过量的Ba2+; 减少一次过滤操作;
Ⅴ.操作④加热煮沸溶液的目的是除去滤液中溶解的CO2和多余的盐酸,以便得到纯净的氯化钠溶液,
故答案为:除去溶解在溶液中的CO2,使过量的HCl挥发.
故答案为:分层,上层紫色,下层为近于无色;苯与水互不相溶,碘在苯中的溶解度比在水中大;
②若从含碘的有机溶液中提取碘和回收有机溶剂,由于碘单质易溶于苯,可以利用其沸点不同,通过蒸馏操作完成;苯的沸点较低,所以蒸馏操作过程中,最后碘在蒸馏烧瓶中聚集,
故答案为:蒸馏;蒸馏烧瓶;
(2)提纯氯化钠的流程为:加热混合物,杂质碳酸氢铵通过分解而除去,得到氯化钠、硫酸钠的混合物;溶解后加入过量氯化钡溶液除去硫酸根离子,再加入过量碳酸钠除去过量的钡离子,过滤除去碳酸钡、硫酸钡沉淀后向滤液中加入盐酸,明确是调节溶液pH除去过量的碳酸根离子,对滤液加热除去溶液中氯化氢和二氧化碳,最后得到纯净的氯化钠溶液,
Ⅰ.根据图示,操作①是将固体混合物加热,使用到的仪器是坩埚,
故答案为:坩埚;
Ⅱ.加入硝酸钠溶液,硝酸钠和硫酸钠反应生成硫酸钡和硝酸钠,除去了硫酸钠,但引入了硝酸钠等新的杂质,
故答案为:不可以,改用Ba(NO3)2会使溶液中引入新的杂质离子NO3-,以后操作中无法除去;
Ⅲ.加入过量氯化钡溶液除去硫酸根离子,检验硫酸根离子已除尽,可静止片刻在上层清液处,滴加一滴氯化钡溶液,不出现浑浊就说明硫酸根离子已经除尽,
故答案为:取少量上层澄清溶液,再滴加BaCl2溶液,如无沉淀出现则说明SO42-已除尽(或其他的方法);
Ⅳ.操作③加入碳酸钠溶液,碳酸钠与过量的氯化钠反应生成碳酸钡和氯化钠,除去过量的氯化钡,再过滤;先过滤而后加碳酸钠溶液,在加入碳酸钠溶液后生成的碳酸钡还需要过滤,增加一次过滤操作;
故答案为:除去过量的Ba2+; 减少一次过滤操作;
Ⅴ.操作④加热煮沸溶液的目的是除去滤液中溶解的CO2和多余的盐酸,以便得到纯净的氯化钠溶液,
故答案为:除去溶解在溶液中的CO2,使过量的HCl挥发.
点评:本题考查了物质的分离、提纯及化学实验基本操作方法的综合应用,题目难度中等,试题知识点较多、综合性较强,明确分离、提纯方案及基本操作方法为解答关键,试题充分考查了学生的分析、理解能力及化学实验能力.

练习册系列答案
 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案
相关题目
实验室里利用以下反应制取少量氮气:NaNO2+NH4Cl═NaCl+N2↑+2H2O.关于该反应的下列说法正确的是( )
| A、每生成1 mol N2转移的电子的物质的量为6 mol |
| B、N2既是氧化剂,又是还原剂 |
| C、NH4Cl中的氮元素被还原 |
| D、NaNO2是氧化剂 |
下列实验操作及结论均正确的是( )
| A、分液操作时,分液漏斗中下层液体从下端放出,上层液体从上口倒出 |
| B、某固体中加入稀盐酸,产生无色无味且能使澄清石灰水变浑浊的气体,证明该固体中一定含有CO32- |
| C、向待测溶液中先加入BaCl2溶液,产生白色沉淀,再加入足量盐酸,沉淀不溶解,证明溶液中一定含有SO42- |
| D、用浓硫酸配制一定物质的量浓度的稀硫酸时,将浓硫酸稀释后,应冷却至室温后再转移到容量瓶中 |
某有机物的化学式为C5H10O,它能发生银镜反应.若将其跟H2加成所得产物的结构简式不可能是( )
| A、CH3(CH2)3CH2OH |
| B、CH3CH2CH(CH3)CH2OH |
| C、(CH3)2CHCH2CH2OH |
| D、(CH3CH2)2CHOH |
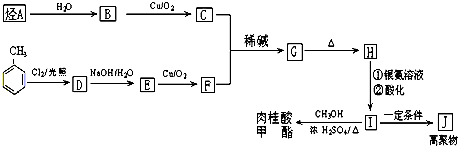
 肉桂酸甲酯是调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精,用于肥皂、洗涤剂、风味剂和糕点的调味,在医药工业中作为有机合成的中间体.
肉桂酸甲酯是调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精,用于肥皂、洗涤剂、风味剂和糕点的调味,在医药工业中作为有机合成的中间体.