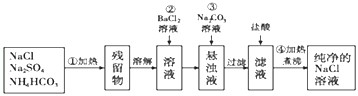
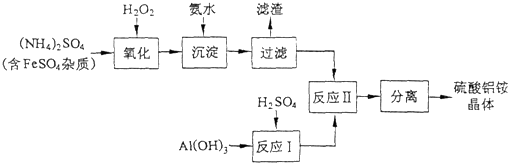
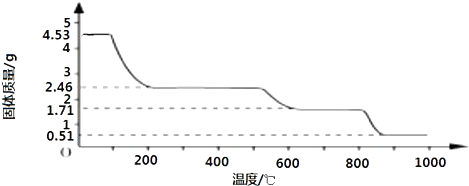
题目内容
下列实验操作及结论均正确的是( )
| A、分液操作时,分液漏斗中下层液体从下端放出,上层液体从上口倒出 |
| B、某固体中加入稀盐酸,产生无色无味且能使澄清石灰水变浑浊的气体,证明该固体中一定含有CO32- |
| C、向待测溶液中先加入BaCl2溶液,产生白色沉淀,再加入足量盐酸,沉淀不溶解,证明溶液中一定含有SO42- |
| D、用浓硫酸配制一定物质的量浓度的稀硫酸时,将浓硫酸稀释后,应冷却至室温后再转移到容量瓶中 |
考点:常见阴离子的检验,分液和萃取
专题:
分析:AD、根据实验操作的规范性分析;
B、无色无味且能使澄清石灰水变浑浊的气体为二氧化碳,能产生此种气体的离子可以为碳酸根、碳酸氢根;
C、氯化银也为白色沉淀.
B、无色无味且能使澄清石灰水变浑浊的气体为二氧化碳,能产生此种气体的离子可以为碳酸根、碳酸氢根;
C、氯化银也为白色沉淀.
解答:
解:A、萃取分液时,为防止引进杂质,分液漏斗下层液体从下口放出,上层液体从上口倒出,故A正确;
B、无色无味且能使澄清石灰水变浑浊的气体为二氧化碳,碳酸根、碳酸氢根能与酸反应生成二氧化碳,故B错误;
C、向待测溶液中先加入BaCl2溶液,产生白色沉淀,可能为硫酸钡或者氯化银,故不一定存在硫酸根,故C错误;
D、用浓硫酸配制一定物质的量浓度的稀硫酸时,将浓硫酸稀释后,应冷却至室温后再转移到容量瓶中,故D正确,
故选AD.
B、无色无味且能使澄清石灰水变浑浊的气体为二氧化碳,碳酸根、碳酸氢根能与酸反应生成二氧化碳,故B错误;
C、向待测溶液中先加入BaCl2溶液,产生白色沉淀,可能为硫酸钡或者氯化银,故不一定存在硫酸根,故C错误;
D、用浓硫酸配制一定物质的量浓度的稀硫酸时,将浓硫酸稀释后,应冷却至室温后再转移到容量瓶中,故D正确,
故选AD.
点评:本题主要考查的是常见仪器的使用以及实验操作需要注意的事项、常见阴离子的检验,检验离子时应首先排除干扰.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
元素X、Y和Z可结合形成化合物XYZ3;X、Y和Z的原子序数之和为26;Y和Z在同一周期.下列有关推测正确的是( )
| A、XYZ3是一种可溶于水的酸,且X与Y可形成共价化合物XY |
| B、XYZ3是一种微溶于水的盐,且Y与Z可形成共价化合物化合物YZ或YZ2 |
| C、XYZ3是一种易溶于水的盐,且X与Z可形成离子化合物XZ |
| D、XYZ3是一种离子化合物,且Y与Z可形成离子化合物YZ3 |
下列反应的离子方程式正确的是( )
| A、铁和盐酸反应:2Fe+6H+=2Fe3++3H2↑ |
| B、硫酸溶液中加入等物质的量氢氧化钡溶液:Ba2++SO42-+OH-+H+=BaSO4↓+H2O |
| C、往澄清石灰水通入过量二氧化碳气体:CO2+OH-=HCO3- |
| D、在醋酸溶液中加入氧化钠:CH3COOH+O2-=CH3COO-+H2O |
对于相同物质的量的SO2和SO3,下列说法正确的是( )
| A、氧元素的质量比为1:1 |
| B、SO2和SO3的质量比为1:1 |
| C、原子总数之比为1:1 |
| D、分子数之比为1:1 |
2013年2月,俄罗斯境内有大量陨石坠落,经化学分析,陨石中游离态的铁含量约为10%,此外还有橄榄石(Fe2SiO4)、亚硫酸盐等成分,下列有关说法正确的是( )
| A、此陨石是一种纯度较高的硅酸盐矿石 |
| B、此陨石具有耐酸碱的特性 |
| C、陨石中含有游离态的铁是因为在外太空中铁的活性比地球上铁的活性低 |
| D、橄榄石中Fe为+2价 |
下列物质水溶液能导电,但是属于非电解质的是( )
| A、NH3 |
| B、(NH4)2SO4 |
| C、Cl2 |
| D、Na2O |