题目内容
茶是我国人民喜爱的饮品.某校化学兴趣小组的同学设计以下实验流程图来定性检验茶叶中的Ca、Al、Fe三种元素.
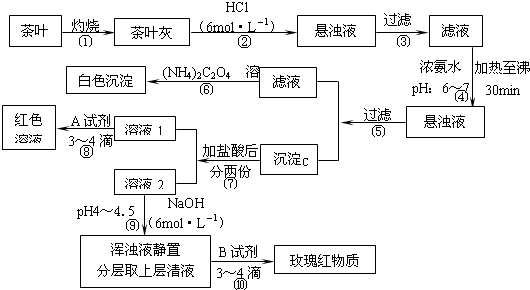
查阅部分资料:草酸铵[(NH4)2C2O4]属于弱电解质;适当浓度的Ca2+、Al3+、Fe3+开始沉淀至沉淀完全的pH范围为:Ca(OH)2,11.8-13.8;Al(OH)3,4.2-5.4;Fe(OH)3,2.7-4.1
试根据上述过程及信息填空:
(1)步骤④用浓氨水调节pH后,加热至沸30min的作用是 ;
(2)写出检验Ca2+的离子方程式 ;
(3)写出沉淀C所含主要物质的化学式 ;
(4)写出步骤⑧用A试剂生成红色溶液的离子方程式 ;
(5)步骤⑨的作用是 ,猜测步骤⑩的目的是 .

查阅部分资料:草酸铵[(NH4)2C2O4]属于弱电解质;适当浓度的Ca2+、Al3+、Fe3+开始沉淀至沉淀完全的pH范围为:Ca(OH)2,11.8-13.8;Al(OH)3,4.2-5.4;Fe(OH)3,2.7-4.1
试根据上述过程及信息填空:
(1)步骤④用浓氨水调节pH后,加热至沸30min的作用是
(2)写出检验Ca2+的离子方程式
(3)写出沉淀C所含主要物质的化学式
(4)写出步骤⑧用A试剂生成红色溶液的离子方程式
(5)步骤⑨的作用是
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:茶叶经灼烧,茶叶灰中含有钙、铁、铝三种金属元素,加入盐酸后可生成可溶性的氯化物,经过滤后,在滤液中加入氨水调节pH6~7,加热至沸30min,经过滤得到的沉淀C为氢氧化铝和氢氧化铁沉淀,滤液为氯化钙溶液,加入草酸铵后可得草酸钙沉淀,在滤液中加入盐酸后分为两份,加入试剂A,溶液变成红色,则A应为KSCN溶液,溶液2中加入6mol/L的NaOH溶液调pH至4,可得到氢氧化铁沉淀,浊液静置分层后上层清液为氯化铝溶液,加入试剂B可检验铝离子,生成红色络合物,以此进行解答.
解答:
解:茶叶经灼烧,茶叶灰中含有钙、铁、铝三种金属元素,加入盐酸后可生成可溶性的氯化物,经过滤后,在滤液中加入氨水调节pH6~7,加热至沸30min,经过滤得到的沉淀C为氢氧化铝和氢氧化铁沉淀,滤液为氯化钙溶液,加入草酸铵后可得草酸钙沉淀,在滤液中加入盐酸后分为两份,加入试剂A,溶液变成红色,则A应为KSCN溶液,溶液2中加入6mol/L的NaOH溶液调pH至4,可得到氢氧化铁沉淀,浊液静置分层后上层清液为氯化铝溶液,加入试剂B可检验铝离子,生成红色络合物.
(1)步骤④在滤液中加入氨水调节pH6~7,加热至沸30min,经过滤得到的沉淀C为氢氧化铝和氢氧化铁沉淀,故答案为:使铁、铝离子以氢氧化物形式完全沉淀;
(2)⑤过滤后所得滤液中含Ca2+,检验Ca2+的离子方程式为:Ca2++(NH4)2C2O4=CaC2O4↓+2NH4+,
故答案为:Ca2++(NH4)2C2O4=CaC2O4↓+2NH4+;
(3)步骤④在pH为6-7时加热30 min,可使Al3+、Fe3+转化成Al(OH)3和Fe(OH)3沉淀,
故答案为:Fe(OH)3、Al(OH)3;
(4)步骤⑧是检验Fe3+,可加入KSCN 或NH4SCN进行检验,溶液变红色,反应的离子方程式为:Fe3++3SCN-=Fe(SCN)3,
故答案为:KSCN 或NH4SCN;
(5)步骤⑨将pH值调节至4~5,此时铝离子没有沉淀而铁离子沉淀完全,步骤⑩分离后用玫瑰红物质可检验Al元素的存在,
故答案为:使Fe3+转化为Fe(OH)3沉淀;检验Al3+(或铝元素)存在.
(1)步骤④在滤液中加入氨水调节pH6~7,加热至沸30min,经过滤得到的沉淀C为氢氧化铝和氢氧化铁沉淀,故答案为:使铁、铝离子以氢氧化物形式完全沉淀;
(2)⑤过滤后所得滤液中含Ca2+,检验Ca2+的离子方程式为:Ca2++(NH4)2C2O4=CaC2O4↓+2NH4+,
故答案为:Ca2++(NH4)2C2O4=CaC2O4↓+2NH4+;
(3)步骤④在pH为6-7时加热30 min,可使Al3+、Fe3+转化成Al(OH)3和Fe(OH)3沉淀,
故答案为:Fe(OH)3、Al(OH)3;
(4)步骤⑧是检验Fe3+,可加入KSCN 或NH4SCN进行检验,溶液变红色,反应的离子方程式为:Fe3++3SCN-=Fe(SCN)3,
故答案为:KSCN 或NH4SCN;
(5)步骤⑨将pH值调节至4~5,此时铝离子没有沉淀而铁离子沉淀完全,步骤⑩分离后用玫瑰红物质可检验Al元素的存在,
故答案为:使Fe3+转化为Fe(OH)3沉淀;检验Al3+(或铝元素)存在.
点评:本题考查了物质性质和组成的实验探究实验分析判断,侧重于学生的分析和实验能力的考查,为高考常见题型,流程中的试剂特征和反应现象是解题关键,题目难度中等.

练习册系列答案
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案
相关题目
在化学反应3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O中,当有1.5molCu被氧化时( )
| A、有2mol硝酸被还原 |
| B、标准状况下有22.4L气体生成 |
| C、转移6mol电子 |
| D、有8mol硝酸参加反应 |
2013年2月,俄罗斯境内有大量陨石坠落,经化学分析,陨石中游离态的铁含量约为10%,此外还有橄榄石(Fe2SiO4)、亚硫酸盐等成分,下列有关说法正确的是( )
| A、此陨石是一种纯度较高的硅酸盐矿石 |
| B、此陨石具有耐酸碱的特性 |
| C、陨石中含有游离态的铁是因为在外太空中铁的活性比地球上铁的活性低 |
| D、橄榄石中Fe为+2价 |


 的名称:
的名称: