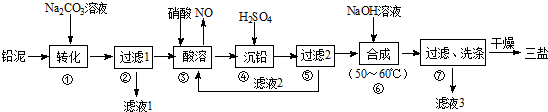
题目内容
12.臭氧是理想的烟气脱硝剂,其脱硝反应为:2NO2(g)+O3(g)?N2O5(g)+O2(g).有关说法正确的是( )| A. | 增大压强可提高反应速率 | |
| B. | 升高温度可减小反应速率 | |
| C. | 若反应物的总能量比生成物的总能量低,说明该反应是放热反应 | |
| D. | 增大氧气的浓度可使NO2转化率为100% |
分析 A.该反应中有气体参与,增大压强能增大反应物浓度而能加快反应速率;
B.无论吸热反应还是放热反应,升高温度加快正逆反应速率;
C.若反应物的总能量比生成物的总能量低,所以是吸热反应;
D.该反应是可逆反应,存在化学反应限度.
解答 解:A.该反应中有气体参与,增大压强能增大反应物浓度而能加快反应速率,所以增大压强能加快反应速率,故A正确;
B.无论吸热反应还是放热反应,升高温度加快正逆反应速率,所以升高温度能加快反应速率,故B错误;
C.若反应物的总能量比生成物的总能量低,所以是吸热反应,而不是放热反应,故C错误;
D.该反应是可逆反应,存在化学反应限度,所以反应物不能完全转化为生成物,故D错误;
故选A.
点评 本题考查化学反应速率影响因素、平衡状态特点、可逆反应特点等知识点,为高考高频点,注意温度对化学反应速率的影响适用于所有的化学反应,易错选项是B.

练习册系列答案
 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案
相关题目
16.下列说法正确的是( )
| A. | 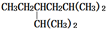 的系统命名法为2,5-二甲基-4-乙基己烷 的系统命名法为2,5-二甲基-4-乙基己烷 | |
| B. | 石油的裂化、煤的气化与液化都属于化学变化,而石油的分馏与煤的干馏都属于物理变化 | |
| C. | 总质量一定时,乙酸和葡萄糖无论以何种比例混合,完全燃烧消耗氧气的量相等 | |
| D. | 油脂、淀粉、蛋白质等高分子化合物都属于混合物,一定条件下均可发生水解 |
17.将过量的二氧化碳分别通入下列溶液,最终溶液中有沉淀析出的是( )
| A. | 氯化钙溶液 | B. | 硅酸钠溶液 | C. | 澄清石灰水 | D. | 饱和碳酸钠溶液 |
14.标号为①~⑩的元素,在元素周期表中的位置如下:
试回答下列问题:
(1)其原子只要形成一对共用电子对就达到了稳定结构的元素是H、F、Cl(填写元素符号).
(2)①和④号元素形成的化合物的化学式为NH3,用电子式表示其形成过程为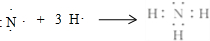 .
.
(3)⑧号元素的最高价氧化物的水化物的化学式是Mg(OH)2.
(4)①、⑤、⑦号元素形成的一种化合物的电子式是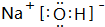 ,在该化合物中既含有离子键,又含有共价键.
,在该化合物中既含有离子键,又含有共价键.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 1 | ① | ② | ||||||
| 2 | ③ | ④ | ⑤ | ⑥ | ||||
| 3 | ⑦ | ⑧ | ⑨ | ⑩ |
(1)其原子只要形成一对共用电子对就达到了稳定结构的元素是H、F、Cl(填写元素符号).
(2)①和④号元素形成的化合物的化学式为NH3,用电子式表示其形成过程为
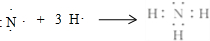 .
.(3)⑧号元素的最高价氧化物的水化物的化学式是Mg(OH)2.
(4)①、⑤、⑦号元素形成的一种化合物的电子式是
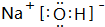 ,在该化合物中既含有离子键,又含有共价键.
,在该化合物中既含有离子键,又含有共价键.
7.已知:FeO(s)+CO(g)?Fe(s)+CO2(g)△H>0
①该反应的平衡常数表达式:K=$\frac{c(C{O}_{2})}{c(CO)}$.
②其平衡常数K与温度T的关系如表:
试判断K1<K2(填写“>”,“=”或“<”).
③若该反应在恒温恒容条件下进行,能说明该反应已达到平衡状态的是bc (填字母).
a.容器内CO2与CO的浓度之比为1:1
b.v(CO2)正=v(CO)逆
c.混合气体的密度保持不变
d.容器内压强保持不变.
①该反应的平衡常数表达式:K=$\frac{c(C{O}_{2})}{c(CO)}$.
②其平衡常数K与温度T的关系如表:
| T/K | 298 | 398 |
| 平衡常数K | K1 | K2 |
③若该反应在恒温恒容条件下进行,能说明该反应已达到平衡状态的是bc (填字母).
a.容器内CO2与CO的浓度之比为1:1
b.v(CO2)正=v(CO)逆
c.混合气体的密度保持不变
d.容器内压强保持不变.
4.下列电离方程式中正确的是( )
| A. | NaHCO3溶于水:NaHCO3═Na++H++CO32- | |
| B. | H2CO3?2H++CO32- | |
| C. | Al(OH)3酸式电离:Al(OH)3═H2O+AlO2-+H+ | |
| D. | NaHSO4熔化:NaHSO4═Na++HSO4- |