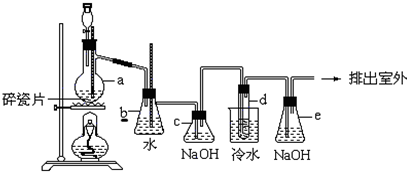
题目内容
2.实验室制取、净化并收集氯气涉及以下几个主要阶段:
现有以下2种试剂:
A.饱和食盐水 B.NaOH溶液
请在以上试剂中选择填空(填“A”或“B”):
①X溶液应选用A.
②尾气处理过程中,多余的氯气可用B吸收.
分析 实验室用浓盐酸与二氧化锰在加热条件下制备氯气,依据浓盐酸易挥发的性质可知制取的氯气中含有氯化氢和水蒸气,要制备纯净的氯气应除去氯化氢和水蒸气,依据氯气、氯化氢性质选择合适的除杂试剂,氯气有毒,直接排放能够引起污染,需要进行尾气处理,氯气能够与碱反应,可以用碱液吸收,据此解答.
解答 解:实验室用浓盐酸与二氧化锰在加热条件下制备氯气,浓盐酸易挥发的性质可知制取的氯气中含有氯化氢和水蒸气,要制备纯净的氯气应除去氯化氢和水蒸气,氯气在饱和食盐水中溶解度不大,氯化氢在水中溶解度较大,所以可以选择饱和食盐水除去氯化氢,然后用浓硫酸干燥即可得到干燥纯净的氯气,氯气有毒排放能够引起污染,需要进行尾气处理,氯气能够与碱反应,可以用氢氧化钠吸收过量的氯气,故①X溶液应选用A;②尾气处理过程中,多余的氯气可用B.
故答案为:①A;②B.
点评 本题考查了氯气的制备和净化及尾气处理,明确制备原理及氯气的性质是解题关键,题目难度不大.

练习册系列答案
 名题金卷系列答案
名题金卷系列答案
相关题目
12.臭氧是理想的烟气脱硝剂,其脱硝反应为:2NO2(g)+O3(g)?N2O5(g)+O2(g).有关说法正确的是( )
| A. | 增大压强可提高反应速率 | |
| B. | 升高温度可减小反应速率 | |
| C. | 若反应物的总能量比生成物的总能量低,说明该反应是放热反应 | |
| D. | 增大氧气的浓度可使NO2转化率为100% |
10.在给定的四种溶液中,加入以下各种离子,各离子能在原溶液中大量共存的是( )
| A. | 滴加石蕊试液显红色的溶液:Fe2+、NH4+、Cl-、NO3- | |
| B. | pH值为1的溶液:Cu2+、Na+、Mg2+、NO3- | |
| C. | 水电离出来的c(H+)=10-12mol/L的溶液:K+、HCO3-、Br-、Ba2+ | |
| D. | 所含溶质为Na2SO4的溶液:K+、HCO3-、NO3-、Al3+ |
17.下列属于氧化还原反应的是( )
| A. | NaOH+HCl=NaCl+H2O | B. | NH4HCO3$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O+CO2↑ | ||
| C. | SO3+H2O=H2SO4 | D. | 2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3 |
14.下列物质中既有有离子键又有共价键的是( )
| A. | Na2S | B. | NaCl | C. | Na2O2 | D. | BaCl2 |
11.下列说法正确的是( )
| A. | 不含其他杂质的天然油脂属于纯净物 | |
| B. | 油脂在酸性条件下水解称为皂化 | |
| C. | 油脂的烃基部分饱和程度越大,熔点越低 | |
| D. | 各种油脂水解后的产物中都有甘油 |