题目内容
12.已知某溶液中只存在OH-、H+、CH3COO-、Na+四种离子,某同学推测其离子浓度大小顺序有如下四种关系:①c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
②c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
③c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
④c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
(1)若溶液中只溶解了一种溶质,则该溶质是CH3COONa,上述四种离子浓度的大小顺序为①(填序号).
(2)若上述关系中③是正确的,则溶液中的溶质是CH3COONa和CH3COOH.
(3)若该溶液由体积相等的氢氧化钠溶液和醋酸溶液混合而成,且恰好呈中性,则混合前两溶液的物质的量浓度大小关系为c(NaOH)小于c(CH3COOH)(填“大于”“小于”“等于”,下同),混合前酸中c(H+)和碱中c(OH-)的关系是:c(H+)小于c(OH-).
(4)水解反应是典型的可逆反应.水解反应的化学平衡常数称为水解常数(用Kh表示),请写出Na2CO3第一步水解反应的水解常数表达式:$\frac{[O{H}^{-}][HC{{O}_{3}}^{-}]}{[C{{O}_{3}}^{2-}]}$.
分析 某溶液中只存在OH-、H+、CH3COO-、Na+四种离子,溶质可能是氢氧化钠和醋酸钠、醋酸钠、醋酸钠和醋酸;
(1)若溶液中只溶解了一种溶质,只能为CH3COONa溶液,由醋酸根离子水解溶液显碱性来分析离子浓度大小;
(2)若上述关系中③是正确的,溶液呈酸性,且c(CH3COO-)>c(Na+),则溶液中的溶质是醋酸钠和醋酸;
(3)若该溶液是由体积相等的氢氧化钠溶液和醋酸溶液混合而成,且恰好呈中性,则c(H+)=c(OH-),当二者浓度相等时,溶液为碱性,若为中性,则醋酸的浓度应该稍大些,氢氧化钠为强电解质、醋酸为弱电解质存在电离平衡,据此判断混合前酸中c(H+)和碱中c(OH-)的关系;
(4)写出水解离子方程式,水解平衡常数等于生成物浓度系数次幂之积与反应物浓度系数次幂之积的比.
解答 解:某溶液中只存在OH-、H+、CH3COO-、Na+四种离子,溶质可能是氢氧化钠和醋酸钠、醋酸钠、醋酸钠和醋酸;
(1)若溶液中只溶解了一种溶质,该溶质只能为CH3COONa,醋酸根离子水解、钠离子不水解,溶液呈碱性,CH3COO-+H2O?CH3COOH+OH-,则c(OH-)>c(H+)、c(Na+)>c(CH3COO-),醋酸根离子水解程度较小,所以c(CH3COO-)>c(OH-),则溶液中离子浓度大小顺序是c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故选①;
故答案为:CH3COONa;①;
(2)若上述关系中③是正确的,溶液呈酸性,且c(CH3COO-)>c(Na+),则溶液中的溶质是CH3COONa和CH3COOH,醋酸电离程度比醋酸根离子水解程度大,溶液显酸性,离子浓度大小为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),
故答案为:CH3COONa和CH3COOH;
(3)醋酸钠是强碱弱酸盐,其溶液呈碱性,若该溶液是由体积相等的氢氧化钠溶液和醋酸溶液混合而成,且恰好呈中性,则c(H+)=c(OH-),要使混合溶液呈中性,则醋酸的物质的量大于氢氧化钠,由于二者体积相等,则混合前两溶液的物质的量浓度大小关系为:c(NaOH)<c(CH3COOH);
要使混合溶液呈中性,则醋酸的物质的量大于氢氧化钠,由于二者体积相等,醋酸是弱酸,部分电离,碱是强碱完全电离,所以混合前酸中c(H+)小于碱溶液中的c(OH-),
故答案为:小于;小于;
(4)碳酸钠溶液中碳酸根离子分步水解,Na2CO3第一步水解反应的离子方程式为:CO32-+H2O?HCO3-+OH-,水解平衡常数等于生成物浓度系数次幂之积与反应物浓度系数次幂之积的比,Kh=$\frac{[O{H}^{-}][HC{{O}_{3}}^{-}]}{[C{{O}_{3}}^{2-}]}$,
故答案为:$\frac{[O{H}^{-}][HC{{O}_{3}}^{-}]}{[C{{O}_{3}}^{2-}]}$.
点评 本题考查了离子浓度大小比较、酸碱混合的定性判断、盐类水解原理,明确溶液中的溶质及溶液酸碱性再结合电荷守恒来分析解答,知道弱电解质电离特点,题目难度中等.

| A. | 在任何条件下,纯水的pH都等于7 | |
| B. | 在任何条件下,纯水都呈中性 | |
| C. | 在95℃时,纯水的 pH小于7,显酸性 | |
| D. | 在95℃时,纯水中的[H+]小于10-7mol•L-1 |
| A. | 0.2mol/L与0.1mol/L醋酸中c(H+)之比为2:1 | |
| B. | pH=2与pH=1的硝酸中c(H+)之比为1:10 | |
| C. | 在50℃时,pH=2的硫酸与pH=12的NaOH溶液等体积混合后,溶液的pH=7 | |
| D. | pH均等于5的HCl溶液和NH4Cl溶液中,水的电离程度相等 |
| A. | NA个二氧化碳分子和0.5mol甲烷的质量比为11:4 | |
| B. | 1molCl2作为氧化剂得到的电子数为NA | |
| C. | 在0℃,101kPa时,11.2L氢气中含有0.5NA个氢原子 | |
| D. | 14g氮气中含有7NA个电子 |
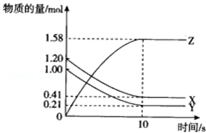 一定温度下,在10L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述正确的( )
一定温度下,在10L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述正确的( )| A. | 反应开始10s时,X的物质的量浓度减少了0.79mol•L-1 | |
| B. | 反应的化学方程式为:2X(g)+2Y(g)═3Z(g) | |
| C. | 反应开始到10s时,已用去的Y占起始量的百分比21% | |
| D. | 反应进行到10s时已达到了平衡状态 |
| A. | CO和HCl | B. | H2,HCl和CO | C. | CO2,CO和HCl | D. | CO2,CO |
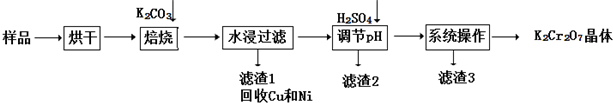
 、
、 、
、 .
.