题目内容
17.若NA表示阿伏加德罗常数,下列说法正确的是( )| A. | NA个二氧化碳分子和0.5mol甲烷的质量比为11:4 | |
| B. | 1molCl2作为氧化剂得到的电子数为NA | |
| C. | 在0℃,101kPa时,11.2L氢气中含有0.5NA个氢原子 | |
| D. | 14g氮气中含有7NA个电子 |
分析 A、NA个二氧化碳分子的物质的量为1mol,然后分别求出二氧化碳和甲烷的质量;
B、氯气作为氧化剂,反应后被还原为-1价;
C、在0℃,101kPa时,气体摩尔体积为22.4L/mol;
D、求出氮气的物质的量,然后根据1mol氮气中含14mol电子来分析.
解答 解:A、NA个二氧化碳分子的物质的量为1mol,质量为44g;0.5mol甲烷的质量为8g,故二氧化碳和甲烷的质量之比为44:8=11:2,故A错误;
B、氯气作为氧化剂,反应后被还原为-1价,故1mol氯气得2mol电子即2NA个,故B错误;
C、在0℃,101kPa时,气体摩尔体积为22.4L/mol,则11.2L氢气的物质的量为0.5mol,则含1mol氢原子即NA个,故C错误;
D、14g氮气的物质的量为0.5mol,而1mol氮气中含14mol电子,故0.5mol氮气中含7mol电子即7NA个,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
7.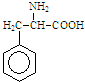 某有机物结构简式如图.一定条件下,该物质与甘氨酸(NH2-CH2-COOH)混合发生反应生成的链状二肽有( )
某有机物结构简式如图.一定条件下,该物质与甘氨酸(NH2-CH2-COOH)混合发生反应生成的链状二肽有( )
 某有机物结构简式如图.一定条件下,该物质与甘氨酸(NH2-CH2-COOH)混合发生反应生成的链状二肽有( )
某有机物结构简式如图.一定条件下,该物质与甘氨酸(NH2-CH2-COOH)混合发生反应生成的链状二肽有( )| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
8.下列说法正确的是( )
| A. | 化学电池中电子由正极流出,经外电路流向负极 | |
| B. | 燃料电池两极板均发生氧化还原反应 | |
| C. | 燃料电池工作时,通常是将空气通向正极 | |
| D. | 化学电池的放电过程就是电能转化为化学能的过程 |
5.已知水的电离方程式:H2O?H++OH-.下列叙述中,正确的是( )
| A. | 升高温度,KW增大,pH不变 | |
| B. | 向水中加入氨水,平衡向逆反应方向移动,c(OH-)降低 | |
| C. | 向水中加入少量硫酸氢钠固体,平衡向逆反应方向移动,c(H+)增大,KW不变 | |
| D. | 向水中加入少量固体CH3COONa,平衡向逆反应方向移动,c(H+)降低 |
2.现有常温下的四份溶液:①0.01 mol•L-1 CH3COOH溶液;②0.01mol•L-1盐酸;③pH=12的氨水;④pH=12的NaOH溶液.下列说法正确的是( )
| A. | 等体积的①、②、④溶液分别与足量铝粉反应,生成H2的量:④最大 | |
| B. | ①中水的电离程度最小,③中水的电离程度最大 | |
| C. | 将四份溶液稀释相同倍数后,溶液的pH:④>③,①>② | |
| D. | 将②、③混合,若pH=7,则消耗溶液的体积:②<③ |
9.今有300mL 0.1mol/L Na2SO4溶液,200mL 0.1mol/L MgSO4溶液和100mL 0.1mol/L Al2(SO4)3溶液,这三种溶液中硫酸根离子浓度之比是( )
| A. | 1:1:1 | B. | 3:2:1 | C. | 3:2:3 | D. | 1:1:3 |
6.下列物质中既能导电,又属于电解质的是( )
| A. | 氯化钠溶液 | B. | 金属铜 | C. | 熔融硫酸钠 | D. | 氯化氢气体 |
7.已知四种白色粉末分别是硝酸钾、氯化镁、氢氧化钡、无水硫酸铜中的一种.现只提供蒸馏水一种试剂,对这些物质进行鉴别(被鉴别出的物质可作为试剂来鉴别其他物质).请按要求填写下列表格:(注意:用化学式填写)
(1)步骤1:
(2)步骤2:
(3)步骤3:
(1)步骤1:
| 加入试剂 | 被检出物质 | 理由 |
| 水 | CuSO4 | CuSO4溶于水溶液显蓝色 |
| 加入试剂 | 被检出物质 | 离子方程式 |
| CuSO4 |
| 加入试剂 | 被检出物质 | 离子方程式 |
| MgCl2 |