题目内容
13.在100mL 3mol/L AlCl3溶液中滴加1mol/L的NaOH溶液,得7.8g沉淀,则加入NaOH溶液的体积可能是300mL和1100mL.分析 100mL 3mol/L的AlCl3溶液中氯化铝的物质的量=0.1L×3mol/L=0.3mol,若Al元素都转化为氢氧化铝沉淀,则氢氧化铝沉淀的质量=0.3mol×78g/mol=23.4g>7.8g,说明有两种情况:一为沉淀不完全,只生成Al(OH)3沉淀;另一种情况为沉淀部分溶解,既生成Al(OH)3沉淀,又生成NaAlO2,结合方程式计算消耗氢氧化钠物质的量,进而计算需要氢氧化钠溶液体积.
解答 解:100mL 3mol/L的AlCl3溶液中氯化铝的物质的量=0.1L×3mol/L=0.3mol,若Al元素都转化为氢氧化铝沉淀,则氢氧化铝沉淀的质量=0.3mol×78g/mol=23.4g>7.8g,说明有两种情况:一为沉淀不完全,只生成Al(OH)3沉淀;另一种情况为沉淀部分溶解,既生成Al(OH)3沉淀,又生成NaAlO2.
n(Al(OH)3)=$\frac{7.8g}{78g/mol}$=0.1mol,
①若碱不足,由Al3++3OH-═Al(OH)3↓可知,
NaOH的物质的量为0.1mol×3=0.3mol,
加入NaOH溶液的体积为$\frac{0.3mol}{1mol/L}$=0.3L=300mL;
②沉淀部分溶解,既生成Al(OH)3沉淀,又生成NaAlO2,则:
Al3++3OH-═Al(OH)3↓
0.3mol 0.9mol 0.3mol
溶解的氢氧化铝为0.3mol-0.1mol=0.2mol,
Al(OH)3+OH-═AlO2-+2H2O
0.2mol 0.2mol
则消耗的碱的物质的量为0.9mol+0.2mol=1.1mol,
加入NaOH溶液的体积为$\frac{1.1mol}{1mol/L}$=1.1L=1100mL;
故答案为:300;1100.
点评 本题考查方程式的有关计算,题目难度中等,关键是根据氯化铝与氢氧化铝的量判断发生的反应,再结合反应的有关方程式计算.

| A. | NH4+、Cl-、NO3-、Na+ | B. | CO32-、NH4+、Cl-、Ca2+ | ||
| C. | 中性溶液中:Fe3+、Cl-、NO3-、Na+ | D. | Fe3+、Cl-、NO3-、Na+、SCN- |
①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ•mol-1
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H2=-1160kJ•mol-1
下列选项正确的是( )
| A. | CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-867 kJ•mol-1 | |
| B. | CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(l)△H3>△H1 | |
| C. | 若用0.2 mol CH4还原NO2至N2,则反应中放出的热量一定为173.4 kJ | |
| D. | 若用标准状况下2.24 L CH4还原NO2至N2,整个过程中转移的电子为1.6 mol |
| A. | NaOH | B. | Na2CO3 | C. | NaI | D. | NaBr |
| A. | 相同物质的量的气体,其气体摩尔体积也相同 | |
| B. | 气体摩尔体积是指1mol任何气体所占的体积为22.4L | |
| C. | 标准状况下的气体摩尔体积约为22.4L/mol | |
| D. | 一定物质的量的气体所占的体积就是气体摩尔体积 |
| A. | Fe( N03)3溶液中加入过量HI溶液:2Fe3++2I-═2Fe2++I2 | |
| B. | 浓烧碱溶液中加入铝片:2A1+20H-═2AlO2-+H2 | |
| C. | H2SO4与Ba(OH)2溶液反应:Ba2+OH-+H++SO42-═BaSO4+H2O | |
| D. | 将新制氢氧化铜悬浊液加入氨水中:Cu(OH)2+4NH3═[Cu(NH3)4]2++2OH - |
| A. | 绿色更浅 | B. | 绿色更深 | C. | 变黄 | D. | 无变化 |
 ;元素Z的离子结构示意图为
;元素Z的离子结构示意图为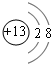 .
.

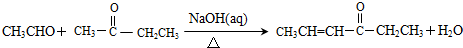
 ,其反应类型是加成反应.
,其反应类型是加成反应.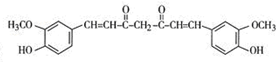 .
.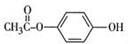 .
.