题目内容
9.(1)现有下列状态的物质①NaHCO3晶体②氯气 ③氨水 ④熔融的KOH ⑤蔗糖⑥铜
其中属于电解质的是①④,属于非电解质的是⑤
(2)
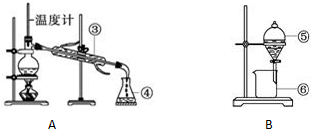
请写出上面仪器③的名称:③冷凝管,写出B装置的实验操作名称分液
(3)除去Fe2O3中混有的Al2O3,可选用试剂:NaOH(填化学式)除去NO中混有的NO2,可选用试剂:H2O(填化学式)
(4)200mL0.5mol/L Al2(SO4)3溶液中,c(Al3+)=1mol/L,在同温同压下,相同质量的O2和O3,它们的体积比3:2;它们的原子数之比1:1
(5)在硫酸铝钾溶液中滴加氢氧化钡溶液,当硫酸根离子沉淀完全时,发生反应的离子方程式为Al3++2(SO4)2-+4OH-+2Ba2+=2BaSO4↓+AlO2-+2H2O.
(6)已知0.1mol/L的NaHSO4溶液中H+的物质的量浓度为0.1mol/L,请写出NaHSO4在水溶液中的电离方程式NaHSO4=Na++H++SO42-.
分析 (1)电解质指:水溶液中或熔融状态下能够导电的化合物,注意能导电,必须是电解质自身电离出自由移动的离子;在上述两种情况下都不能导电的化合物称为非电解质,蔗糖、乙醇等都是非电解质;单质,混合物既不是电解质也不是非电解质;
(2)依据仪器构造说出其名称,依据装置用到的仪器说出实验操作名称;
(3)氧化铝与氢氧化钠反应生成易溶于水的偏铝酸钠,氧化铁与氢氧化钠溶液不反应;二氧化氮与水反应生成一氧化氮,一氧化氮与水不反应,且不溶于水;
(4)硫酸铝为强电解质,完全电离,所以铝离子浓度为硫酸铝浓度3倍;相同条件下,体积之比等于物质的量之比;气体质量为氧元素质量,氧原子的摩尔质量相同,质量相同氧原子数目相同;
(5)在硫酸铝钾溶液中滴加氢氧化钡溶液,当硫酸根离子恰好沉淀完全时,1molKAl(SO4)2需要消耗2molBa(OH)2;
(6)硫酸氢钠为强电解质,在水中完全电离生成钠离子、氢离子、硫酸根离子.
解答 解:(1)①NaHCO3晶体水溶液中或熔融状态下能够导电的化合物,属于电解质;
②氯气是单质,既不是电解质,也不是非电解质;
③氨水是混合物,既不是电解质,也不是非电解质;
④熔融的KOH能够导电的化合物,属于电解质;
⑤蔗糖溶液中和熔融状态下都不能够导电的化合物,是非电解质;
⑥铜是单质,既不是电解质,也不是非电解质;
所以属于电解质的是①④,属于非电解质的是⑤;
故答案为:①④;⑤;
(2)依据仪器形状可知③为冷凝管;B装置用到主要仪器为分液漏斗,实验操作名称分液;
故答案为:冷凝管;分液;
(3)氧化铝与氢氧化钠反应生成易溶于水的偏铝酸钠,氧化铁与氢氧化钠溶液不反应,所以可以用氢氧化钠溶液除去Fe2O3中混有的Al2O3;
二氧化氮与水反应生成一氧化氮,一氧化氮与水不反应,且不溶于水,所以可以用水除去NO中混有的NO2;
故答案为:NaOH;H2O;
(4)200mL0.5mol/L Al2(SO4)3溶液中,c(Al3+)=0.5mol/L×2=1mol/L;
设O2和O3的质量为48g,O2的物质的量为1.5mol,O3的物质的量为1mol,相同条件下,体积之比等于物质的量之比,所以相同质量的O2和O3的体积比为1.5mol:1mol=3:2;气体质量为氧元素质量,氧原子的摩尔质量相同,质量相同氧原子数目相同为1:1;
故答案为:1mol/L;3:2;1:1;
(5)在硫酸铝钾溶液中滴加氢氧化钡溶液,当硫酸根离子恰好沉淀完全时,1molKAl(SO4)2需要消耗2molBa(OH)2,反应离子方程式:Al3++2(SO4)2-+4OH-+2Ba2+=2BaSO4↓+AlO2-+2H2O,
故答案为:Al3++2(SO4)2-+4OH-+2Ba2+=2BaSO4↓+AlO2-+2H2O;
(6)硫酸氢钠为强电解质,在水中完全电离生成钠离子、氢离子、硫酸根离子,电离方程式:NaHSO4=Na++H++SO42-;
故答案为:NaHSO4=Na++H++SO42-.
点评 本题为综合题,涉及电解质、非电解质判断,实验仪器及操作,离子方程式的书写,有关物质的量的计算,题目难度不大,掌握基础是解题关键.

| A. | 赤铁矿的主要成分是Fe3O4 | |
| B. | FeO俗称铁红 | |
| C. | Fe和水蒸气在高温条件下的反应产物是Fe2O3和H2 | |
| D. | 向FeCl2溶液中滴加NaOH,先生成白色沉淀迅速变成灰绿色,最终变为红褐色 |
 所示,下列说法正确的是( )
所示,下列说法正确的是( )| A. | 该有机物的分子式为C8H8O3 | |
| B. | 1 mol该有机物最多能与2 mol H2发生加成反应 | |
| C. | 该有机物能发生加成反应,取代反应和氧化反应 | |
| D. | 该有机物的一种芳香族同分异构体能含一个羧基 |
| A. | 容量瓶和分液漏斗在使用前均要检验是否漏水 | |
| B. | 过滤和蒸馏都是利用微粒的大小来分离物质的一种物理方法 | |
| C. | 碘易溶于有机溶剂,可用CCl4萃取碘水中的碘 | |
| D. | 把几滴FeCl3饱和溶液滴入25mL沸水继续加热可制备Fe(OH)3胶体 |
| A. | Na2O2 | B. | FeCl2 | C. | 漂白粉 | D. | Na2CO3 |
| A. | Ca2+、HCO3-、Cl-、K+ | B. | Al3+、AlO2-、H+、Na+ | ||
| C. | Fe2+、NH4+、SO42-、S2- | D. | Fe3+、SCN-、Na+、CO32- |
| A. | 化学反应是旧键断裂和新键形成的过程 | |
| B. | 放热反应的反应速率总是大于吸热反应的反应速率 | |
| C. | 应用盖斯定律,可计算某些难以直接测量的反应焓变 | |
| D. | 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H相同 |

 .
.