题目内容
1.某有机物A遇FeCl3溶液显紫色,1molA最多能与3molNaOH反应,经测定,A的分子式为C8H8O3并且含有二取代苯结构,则A的结构式的数目为( )| A. | 2 | B. | 3 | C. | 4 | D. | 5 |
分析 分子式为C8H8O3,遇FeCl3溶液显紫色,说明是酚,苯环上直接连接一个-OH,有二取代苯结构,1molA最多能与3molNaOH反应,则另一个取代基为-OOCCH3,与-OH的相对位置为邻、间、对三种.
解答 解:分子式为C8H8O3,遇FeCl3溶液显紫色,说明是酚,苯环上直接连接一个-OH,该有机物有二取代苯结构,1molA最多能与3molNaOH反应,则另一个取代基为-OOCCH3,与-OH的相对位置为邻、间、对三种,
故选B.
点评 本题考查了同分异构体的判断,难度中等,掌握酚和酯的性质是解题的关键,注意位置异构的应用.

练习册系列答案
相关题目
11.将9g铜和铁的混合物投入100mL稀硝酸中,充分反应后得到标准状况下1.12L NO,剩余4.8g金属;继续加入100mL等浓度的稀硝酸,金属完全溶解,又得到标准状况下1.12L NO.则下列说法正确的是( )
| A. | 第一次剩余4.8 g金属为铜和铁 | |
| B. | 稀硝酸的物质的量浓度为1.0 mol•L-1 | |
| C. | 原混合物中铜和铁各0.075 mol | |
| D. | 再加入上述100 mL稀硝酸,又得到标准状况下1.12 L NO |
12.NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 16 g CH4与18 g NH4+所含的质子数均为10NA | |
| B. | 将15.6 g Na2O2投入到足量水中,反应后溶液中的氧原子数为0.4NA | |
| C. | 在1 L 0.1 mol•L-1的碳酸钠溶液中,阴离子总数一定大于0.1NA | |
| D. | 2 mol NO和1 mol O2混合,所得气体的分子数为2NA |
9. 室温下,将1.000mol•L-1盐酸滴入20.00mL 1.000mol•L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法不正确的是( )
室温下,将1.000mol•L-1盐酸滴入20.00mL 1.000mol•L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法不正确的是( )
 室温下,将1.000mol•L-1盐酸滴入20.00mL 1.000mol•L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法不正确的是( )
室温下,将1.000mol•L-1盐酸滴入20.00mL 1.000mol•L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法不正确的是( )| A. | a点水的离子积Kw=1.0×10-14 | |
| B. | b点:c(NH4+)+c(H+)=c(Cl-)+c(OH-) | |
| C. | c点:c(Cl-)=c(NH4+) | |
| D. | d点后,溶液温度略下降的主要原因是NH3•H2O电离吸热 |
16.用惰性电极电解下列溶液,一段时间后,再加入一定质量的另一种物质(括号内),能使溶液完全复原的是( )
| A. | NaOH(NaOH) | B. | CuCl2(CuO) | C. | NaCl(HCl) | D. | CuSO4(H2O) |
13.下列有关胶体与溶液的叙述错误的是( )
| A. | 都是混合物 | B. | 胶体比溶液更隐定 | ||
| C. | 都属于分散系 | D. | 用丁达尔效应区分胶体与溶液 |
10.短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,已知Y、W的原子序数之和是Z的3倍,下列说法正确的是( )
| Y | Z | ||
| X | W |
| A. | 原子半径:X<Y<Z | |
| B. | 最高价氧化物的水化物的酸性:Y<W | |
| C. | 原子序数:X>W>Z>Y | |
| D. | Z、Y的单质均可与H2反应,且反应的剧烈程度:Y>Z |
11.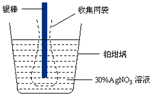 精确测量金属离子在惰性电极上以镀层形式沉积的金属质量,可以确定电解过程中通过电解池的电量.实际测量中常用的银电量计结构如图所示,下列说法不正确的是( )
精确测量金属离子在惰性电极上以镀层形式沉积的金属质量,可以确定电解过程中通过电解池的电量.实际测量中常用的银电量计结构如图所示,下列说法不正确的是( )
 精确测量金属离子在惰性电极上以镀层形式沉积的金属质量,可以确定电解过程中通过电解池的电量.实际测量中常用的银电量计结构如图所示,下列说法不正确的是( )
精确测量金属离子在惰性电极上以镀层形式沉积的金属质量,可以确定电解过程中通过电解池的电量.实际测量中常用的银电量计结构如图所示,下列说法不正确的是( )| A. | 电量计中的银棒应与电源的正极相连,铂坩埚上发生的电极反应是:Ag++e-=Ag | |
| B. | 实验中,为了避免银溶解过程中可能产生的金属颗粒掉进铂坩埚而导致测量误差,常在银电极附近增加一个收集网袋.若没有收集网袋,测量结果会偏高 | |
| C. | 已知每摩尔电子的电量为965 00 C,若称量电解前后铂坩埚的质量变化值为108.0 mg,则电解过程中通过电解池的电量为96.5 C | |
| D. | 若要测定电解精炼铜时通过的电量,可将该银电量计中的银棒与待测电解池的粗铜电极相连 |
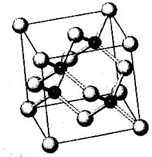 N、P、As、Ga、Cr等元素化合物种类繁多,具有重要的研究价值和应用价值.请回答下列问题:
N、P、As、Ga、Cr等元素化合物种类繁多,具有重要的研究价值和应用价值.请回答下列问题: