题目内容
17.现有7种元素的性质、数据如表所列,它们属于第二或第三周期.编号 性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 |
| 最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | |
| -2 | -3 | -1 | -3 |
(1)③原子结构示意图是
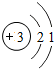 ,⑤的氢化物和⑦的氢化物形成化合物的电子式
,⑤的氢化物和⑦的氢化物形成化合物的电子式 .
.(2)在最高价氧化物的水化物中,碱性最强的化合物的电子式是:
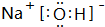 ; 属离子化合物(填“离子”或“共价”).
; 属离子化合物(填“离子”或“共价”).(3)比较④和⑦的氢化物的稳定性(用化学式表示):NH3>PH3.
(4)写出⑦的最高价氧化物对应水化物跟它的氢化物反应的化学方程式:NH3+HNO3=NH4NO3.
分析 ①没有最高价、只有最低价-2,可推知①为O;③⑥都有最高价+1,处于ⅠA族,且⑥的原子半径较大,故③为Li、⑥为Na;②有最高价+2,处于ⅡA族,原子半径大于Li,故②为Mg;④⑦都有最高价+5、最低价-3,处于ⅤA族,且④的原子半径较大,故④为P、⑦为N;⑤有最高价+7、最低价-1,则⑤为
Cl,据此解答.
解答 解:①没有最高价、只有最低价-2,可推知①为O;③⑥都有最高价+1,处于ⅠA族,且⑥的原子半径较大,故③为Li、⑥为Na;②有最高价+2,处于ⅡA族,原子半径大于Li,故②为Mg;④⑦都有最高价+5、最低价-3,处于ⅤA族,且④的原子半径较大,故④为P、⑦为N;⑤有最高价+7、最低价-1,则⑤为Cl,
(1)由上述分析可知,③的元素符号是Li,原子结构示意图为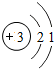 ,⑤的氢化物为HCl,⑦的氢化物为NH3,形成化合物为氯化铵,电子式为
,⑤的氢化物为HCl,⑦的氢化物为NH3,形成化合物为氯化铵,电子式为 ,
,
故答案为: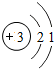 ;
; ;
;
(2)上述元素中,Na元素的金属性最强,碱性最强的化合物为NaOH,其电子式为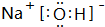 ,属于离子化合物,
,属于离子化合物,
故答案为: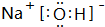 ;离子;
;离子;
(3)④为P、⑦为N,二者同主族,电子层越多非金属性越弱,故非金属性N>P,则氢化物稳定性NH3>PH3,
故答案为:NH3;PH3;
(4)⑦的最高价氧化物对应水化物为硝酸,它的氢化物为氨气,二者反应的化学方程式为:NH3+HNO3=NH4NO3,
故答案为:NH3+HNO3=NH4NO3.
点评 本题考查结构性质位置关系应用,难度中等,关键是根据化合价与原子半径推断元素,注意元素周期律的理解掌握.

练习册系列答案
相关题目
7.将盛有NH4HCO3的试管加热,使放出的气体依次通过盛有足量Na2O2的干燥管、足量浓硫酸的洗气瓶,最后得到的气体是( )
| A. | O2 | B. | NH3 | C. | H2O | D. | CO2 |
8.下列说法不正确的是( )
| A. | 用新制氢氧化铜悬浊液可以鉴别乙酸、葡萄糖和淀粉三种溶液 | |
| B. | 用重铬酸钾溶液检验司机是否酒驾所发生的反应属于乙醇的氧化反应 | |
| C. | 将铜丝在酒精灯上加热后,立即伸入无水乙醇中,铜丝恢复成原来的红色 | |
| D. | 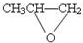 和CO2反应生成可降解聚合物 和CO2反应生成可降解聚合物 ,该反应不符合绿色化学原则 ,该反应不符合绿色化学原则 |
5.设NA代表阿伏加德罗常数(NA)的数值,下列说法正确的是( )
| A. | 标准状况下,2.24L戊烷所含分子数为0.1 NA | |
| B. | 乙烯和环丙烷(C3H6)组成的28g混合气体中含有4NA个氢原子 | |
| C. | 17.6g丙烷中所含的极性共价键为4NA个 | |
| D. | 常温常压下,22.4L乙烯中C-H键数为NA |
2.化学与科学、技术、社会、环境密切相关.下列有关说法中,正确的是( )
| A. | 钢、青铜、硬铝和金刚石都是合金材料 | |
| B. | 铝合金的熔点和硬度均高于纯铝 | |
| C. | 铝合金的大量使用是因为人们能用焦炭等还原剂从氧化铝中获得铝 | |
| D. | 不锈钢和目前流通的硬币都是合金 |
9.下列实验能达到目的是( )
| A. | 只滴加氨水鉴别NaCl、AlCl3、MgCl2、Na2SO4四种溶液 | |
| B. | 将NH4Cl溶液蒸干可制备NH4Cl固体 | |
| C. | 测定NaOH熔点时,可以将NaOH放入石英坩埚中高温加热 | |
| D. | 浓硝酸应保存在棕色试剂瓶中,氢氟酸不能保存在玻璃瓶中 |
6.NA为阿佛加德罗常数,下述正确的是( )
| A. | 12 kg12C含有NA个碳原子 | |
| B. | 1L 1mol/L的盐酸溶液中,所含氯化氢分子数为NA | |
| C. | 标准状况下,11.2L四氯化碳所含分子数为0.5 NA | |
| D. | 在铁与硫的反应中,1mol铁失去的电子数为2 NA |
7.同位素示踪法可用于反应机理的研究,下列反应中同位素示踪表示正确的是( )
| A. | CH3COOH+CH3CH218OH═CH3COOCH2CH3+H218O | |
| B. | K37ClO3+6HCl═K37Cl+3Cl2↑+3H2O | |
| C. | 2Na218O2+2H2O═4Nal8OH+O2↑ | |
| D. | 2KMnO4+5H218O2+3H2SO4═K2SO4+2MnSO4+518O2↑+8H2O |


 .
.
 .
.