题目内容
5.设NA代表阿伏加德罗常数(NA)的数值,下列说法正确的是( )| A. | 标准状况下,2.24L戊烷所含分子数为0.1 NA | |
| B. | 乙烯和环丙烷(C3H6)组成的28g混合气体中含有4NA个氢原子 | |
| C. | 17.6g丙烷中所含的极性共价键为4NA个 | |
| D. | 常温常压下,22.4L乙烯中C-H键数为NA |
分析 A.标准状况下,戊烷不是气体,不能使用标况下的气体摩尔体积计算戊烷的物质的量;
B.乙烯和环丙烷最简式相同,计算28gCH2中含有的氢原子数;
C.依据n=$\frac{m}{M}$计算物质的量,结合丙烷结构特征分析计算;
D.常温常压下,气体摩尔体积大于22.4L/mol.
解答 解:A.标况下戊烷不是气体,不能使用标况下气体摩尔体积计算2.24L戊烷的物质的量,故A错误;
B.乙烯和环丙烷最简式相同,所以28g混合气体中含有的氢原子数只要计算28gCH2中氢原子数即可,28gCH2中氢原子数=$\frac{28g}{14g/mol}$=4mol,即混合气体中含有4NA个氢原子,故B正确;
C.依据n=$\frac{m}{M}$计算物质的量 $\frac{17.6g}{44g/mol}$=0.4mol,结合丙烷结构特征分析计算含有极性共价键=0.4mol×8×NA=3.2NA,故C错误;
D.常温常压下,气体摩尔体积大于22.4L/mol,故22.4L乙烯的物质的量小于1mol,则含有的C-H键数小于4NA个,故D错误;
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,注意标准状况下气体摩尔体积为22.4L/mol,题目难度不大.

练习册系列答案
相关题目
15.下列关于物质鉴别的方法中不正确的是( )
| A. | 可用酸性高锰酸钾溶液鉴别甲烷和乙烯气体 | |
| B. | 可用淀粉溶液鉴别KI和KBr溶液 | |
| C. | 可用澄清石灰水检验H2和CH4的燃烧产物 | |
| D. | 可用溴水鉴别苯和四氯化碳 |
16.下列有机物的一氯代物是四种的是( )
①异戊烷 ②甲苯 ③2-丁烯 ④对二甲苯.
①异戊烷 ②甲苯 ③2-丁烯 ④对二甲苯.
| A. | ①② | B. | ①③ | C. | ②④ | D. | ③④ |
13.两种气态烃的混和物共0.1mol,完全燃烧后得到3.36L(标准状况下)CO2和3.6g水,下列说法正确的是( )
| A. | 可能有甲烷 | B. | 一定有乙烯 | C. | 可能有乙烷 | D. | 可能有乙烯 |
10.关于晶体与非晶体的说法正确的是( )
| A. | 晶体一定比非晶体的熔点高 | B. | 晶体有自范性但排列无序 | ||
| C. | 非晶体无自范且排列无序 | D. | 晶体一定无色透明 |
17.现有7种元素的性质、数据如表所列,它们属于第二或第三周期.
回答下列问题:
(1)③原子结构示意图是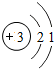 ,⑤的氢化物和⑦的氢化物形成化合物的电子式
,⑤的氢化物和⑦的氢化物形成化合物的电子式 .
.
(2)在最高价氧化物的水化物中,碱性最强的化合物的电子式是: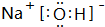 ; 属离子化合物(填“离子”或“共价”).
; 属离子化合物(填“离子”或“共价”).
(3)比较④和⑦的氢化物的稳定性(用化学式表示):NH3>PH3.
(4)写出⑦的最高价氧化物对应水化物跟它的氢化物反应的化学方程式:NH3+HNO3=NH4NO3.
编号 性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 |
| 最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | |
| -2 | -3 | -1 | -3 |
(1)③原子结构示意图是
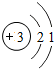 ,⑤的氢化物和⑦的氢化物形成化合物的电子式
,⑤的氢化物和⑦的氢化物形成化合物的电子式 .
.(2)在最高价氧化物的水化物中,碱性最强的化合物的电子式是:
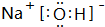 ; 属离子化合物(填“离子”或“共价”).
; 属离子化合物(填“离子”或“共价”).(3)比较④和⑦的氢化物的稳定性(用化学式表示):NH3>PH3.
(4)写出⑦的最高价氧化物对应水化物跟它的氢化物反应的化学方程式:NH3+HNO3=NH4NO3.
 一家人其乐融融地坐在大彩电前欣赏精彩的电视剧是一件很温馨的事情,带给我们幸福的大彩电离不开高分子物质,其中制造彩电荧光屏的高分子材料具有感光性,称为“光敏性高分子”,其结构简式如图所示.
一家人其乐融融地坐在大彩电前欣赏精彩的电视剧是一件很温馨的事情,带给我们幸福的大彩电离不开高分子物质,其中制造彩电荧光屏的高分子材料具有感光性,称为“光敏性高分子”,其结构简式如图所示. ,该单体可由
,该单体可由 和CH2=CH-OH经酯化(或取代)反应(填反应类型)得到.
和CH2=CH-OH经酯化(或取代)反应(填反应类型)得到.