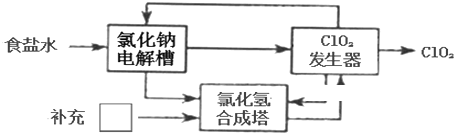
��Ŀ����
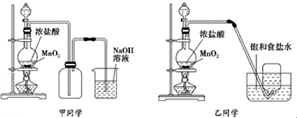
 �����״���ԭ��CO��H2�������з�Ӧ��ȡ��CH4��g��+H2O��g��?CO��g��+3H2��g�����Իش��������⣮
�����״���ԭ��CO��H2�������з�Ӧ��ȡ��CH4��g��+H2O��g��?CO��g��+3H2��g�����Իش��������⣮����֪��CH4��g��+
| 3 |
| 2 |
H2��g��+
| 1 |
| 2 |
��CH4��g��+H2O��g��?CO��g��+3H2��g���ġ�H=
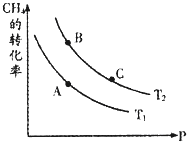
��һ�������·�ӦCH4��g��+H2O��g��?CO+3H2��g����CH4��ƽ��ת�������¶ȡ�ѹǿ�Ĺ�ϵ��ͼ����T2��T1����������Ӧ�ġ�H
��ά���¶�T2����0.04mol CH4��g����0.04mol H2O��g��ͨ���ݻ�Ϊ1L�Ķ����ܱ������з�����Ӧ��ƽ��ʱ�ﵽB�㣬���CH4��ת����Ϊ50%���÷�Ӧ�ڴ��¶��µ�ƽ�ⳣ��KB=
A��������CH4�pH2O�pCO�pH2��λ���ʵ���֮��Ϊ1��1��1��3
B��������������ܶȺ㶨
C�������������ѹǿ�㶨
D.3v��CO��=v��H2��
��������B��ƽ������ϣ�����������ͨ��a mol CH4��a mol H2O���壬ʹ֮��C�����´�ƽ�⣬��ʱ���CO��0.03mol����a=
���㣺�Ȼ�ѧ����ʽ,��ѧƽ���Ӱ������,��ѧƽ��״̬���ж�,ת�������¶ȡ�ѹǿ�ı仯����,��ѧƽ��ļ���
ר�⣺��ѧƽ��ר��
�������������Ȼ�ѧ����ʽ��˹���ɼ��������Ȼ�ѧ����ʽ��
�����ݶ�һ����ķ�����ѹǿ���䣬���¶�������ת��������˵������ƽ��������У�ƽ�ⳣ������
�����ݻ�ѧ����ʽ��ʽ����ƽ��Ũ�ȣ����ƽ�ⳣ���������õ�����ѧ��Ӧ�ﵽƽ��ı�־�����淴Ӧ������ͬ������ֺ������ֲ������ѡ�
��B��ı�Ũ��ƽ�ⳣ�����䣬����ƽ�ⳣ��������ʽ���㣻
�����ݶ�һ����ķ�����ѹǿ���䣬���¶�������ת��������˵������ƽ��������У�ƽ�ⳣ������
�����ݻ�ѧ����ʽ��ʽ����ƽ��Ũ�ȣ����ƽ�ⳣ���������õ�����ѧ��Ӧ�ﵽƽ��ı�־�����淴Ӧ������ͬ������ֺ������ֲ������ѡ�
��B��ı�Ũ��ƽ�ⳣ�����䣬����ƽ�ⳣ��������ʽ���㣻
���
�⣺����֪��a��CH4��g��+
O2��g��?CO��g��+2H2O��g����H1
b��H2��g��+
O2��g��?H2O��g����H2
���ݸ�˹���ɼ���a-3b�õ���CH4��g��+H2O��g��?CO��g��+3H2��g���ġ�H=����H1-3��H2 ��
�ʴ�Ϊ����H1-3��H2 ��
��һ�������·�ӦCH4��g��+H2O��g��?CO+3H2��g����CH4��ƽ��ת�������¶ȡ�ѹǿ�Ĺ�ϵ��ͼ����T2��T1��ѹǿ���䣬���¶�������ת��������˵������ƽ��������У�����Ӧ��H��0��ƽ�ⳣ������KA��KB����
�ʴ�Ϊ����������
��ά���¶�T2����0.04mol CH4��g����0.04mol H2O��g��ͨ���ݻ�Ϊ1L�Ķ����ܱ������з�����Ӧ��ƽ��ʱ�ﵽB�㣬���CH4��ת����Ϊ50%�����ݻ�ѧƽ������ʽ��ʽ��
CH4��g��+H2O��g��?CO��g��+3H2��g��
��ʼ����mol/L�� 0.04 0.04 0 0
�仯����mol/L��0.02 0.02 0.02 0.06
ƽ������mol/L��0.02 0.02 0.02 0.06
ƽ�ⳣ��K=
=0.0108
CH4��g��+H2O��g��?CO��g��+3H2��g����Ӧ�����������������ȷ�Ӧ��
A��������CH4�pH2O�pCO�pH2��λ���ʵ���֮��Ϊ1��1��1��3�����Ϸ�Ӧ�ȣ�������˵�����淴Ӧ������ͬ������˵����Ӧ�ﵽƽ��״̬����A����
B����Ӧǰ������������������䣬������������ܶ�ʼ�պ㶨������˵����Ӧ�ﵽƽ��״̬����B����
C����Ӧǰ������������������������ѹǿ�㶨˵����Ӧ�ﵽƽ��״̬����C��ȷ��
D.3v��CO��=v��H2�����Ƿ�Ӧ����֮�ȵ��ڻ�ѧ����ʽ������֮�ȣ�������˵�����淴Ӧ������ͬ����D����
�ʴ�Ϊ��0.0108��C��
��������B��ƽ������ϣ�����������ͨ��a mol CH4��a mol H2O���壬ʹ֮��C�����´�ƽ�⣬��ʱ���CO��0.03mol���¶Ȳ��䣬ƽ�ⳣ�����䣬�������ʽ��ʽ����õ���
CH4��g��+H2O��g��?CO��g��+3H2��g��
��ʼ����mol/L�� 0.04+a 0.04+a 0 0
�仯����mol/L��0.03 0.03 0.03 0.09
ƽ������mol/L��0.01+a 0.01+a 0.03 0.09
K=
=0.0108��a=0.035��
�ʴ�Ϊ��0.035��
| 3 |
| 2 |
b��H2��g��+
| 1 |
| 2 |
���ݸ�˹���ɼ���a-3b�õ���CH4��g��+H2O��g��?CO��g��+3H2��g���ġ�H=����H1-3��H2 ��
�ʴ�Ϊ����H1-3��H2 ��
��һ�������·�ӦCH4��g��+H2O��g��?CO+3H2��g����CH4��ƽ��ת�������¶ȡ�ѹǿ�Ĺ�ϵ��ͼ����T2��T1��ѹǿ���䣬���¶�������ת��������˵������ƽ��������У�����Ӧ��H��0��ƽ�ⳣ������KA��KB����
�ʴ�Ϊ����������
��ά���¶�T2����0.04mol CH4��g����0.04mol H2O��g��ͨ���ݻ�Ϊ1L�Ķ����ܱ������з�����Ӧ��ƽ��ʱ�ﵽB�㣬���CH4��ת����Ϊ50%�����ݻ�ѧƽ������ʽ��ʽ��
CH4��g��+H2O��g��?CO��g��+3H2��g��
��ʼ����mol/L�� 0.04 0.04 0 0
�仯����mol/L��0.02 0.02 0.02 0.06
ƽ������mol/L��0.02 0.02 0.02 0.06
ƽ�ⳣ��K=
| 0.02��0.063 |
| 0.02��0.02 |
CH4��g��+H2O��g��?CO��g��+3H2��g����Ӧ�����������������ȷ�Ӧ��
A��������CH4�pH2O�pCO�pH2��λ���ʵ���֮��Ϊ1��1��1��3�����Ϸ�Ӧ�ȣ�������˵�����淴Ӧ������ͬ������˵����Ӧ�ﵽƽ��״̬����A����
B����Ӧǰ������������������䣬������������ܶ�ʼ�պ㶨������˵����Ӧ�ﵽƽ��״̬����B����
C����Ӧǰ������������������������ѹǿ�㶨˵����Ӧ�ﵽƽ��״̬����C��ȷ��
D.3v��CO��=v��H2�����Ƿ�Ӧ����֮�ȵ��ڻ�ѧ����ʽ������֮�ȣ�������˵�����淴Ӧ������ͬ����D����
�ʴ�Ϊ��0.0108��C��
��������B��ƽ������ϣ�����������ͨ��a mol CH4��a mol H2O���壬ʹ֮��C�����´�ƽ�⣬��ʱ���CO��0.03mol���¶Ȳ��䣬ƽ�ⳣ�����䣬�������ʽ��ʽ����õ���
CH4��g��+H2O��g��?CO��g��+3H2��g��
��ʼ����mol/L�� 0.04+a 0.04+a 0 0
�仯����mol/L��0.03 0.03 0.03 0.09
ƽ������mol/L��0.01+a 0.01+a 0.03 0.09
K=
| 0.03��0.093 |
| (0.01+a)2 |
�ʴ�Ϊ��0.035��
���������⿼�����Ȼ�ѧ����ʽ��д��������ѧƽ��Ӱ�����غ�ƽ���־�ķ����жϣ�ƽ�ⳣ����Ӧ���ʼ���Ӧ�ã����ջ����ǹؼ�����Ŀ�Ѷ��еȣ�

��ϰ��ϵ�д�
�����Ŀ
���й���NO��NO2��������ȷ���ǣ�������
| A�������¶�����ɫ���� |
| B�������¶�������ˮ |
| C��һ�������£����ת�� |
| D����������ˮ���ռ� |
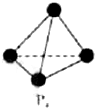 ����ѧ-ѡ��3�����ʽṹ�����ʡ�
����ѧ-ѡ��3�����ʽṹ�����ʡ�