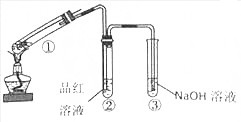
题目内容
10.有机合成在制药工业上有着极其重要的地位.现用硝基苯制取苯胺,再用苯胺制得无色晶体乙酰苯胺(具有退热镇痛作用的药物).①化学反应原理为:

②相关物质的物理常数
| 物质 | 相对分子质量 | 熔点(℃) | 沸点 | 溶解度(g) | |
| 水 | 乙醇 | ||||
| 苯胺 | 93 | -6 | 184 | 3.42(20℃) | 任意比混溶 |
| 乙酸 | 60 | 17 | 117.9 | 任意比混溶 | 任意比混溶 |
| 乙酰苯胺 | 135 | 114 | 304 | 0.56(20℃) 3.45(50℃) 5.20(100℃) | 36.9(20℃) |

已知:Ⅰ苯胺易被氧化;Ⅱ韦氏分馏柱作用与原理类似于冷凝管
请回答以下问题:
(1)加入锌粒的目的是制备氢气防止苯胺被氧化;韦氏分馏柱作用的是冷凝回流乙酸和苯胺,提高原料的利用率;
(2)步骤1中保持柱顶温度约为105℃,则锥形瓶中收集到的馏分主要是H2O;
(3)步骤2中将反应液倒入水中的目的是洗去未反应的乙酸和苯胺,同时降低乙酰苯胺的溶解度,促使其析出;
(4)步骤3中洗涤剂最好选择A;
A.冷水 B.热水 C.15%的乙醇溶液 D.NaOH溶液
(5)步骤4重结晶的过程:粗产品溶于沸水中配成饱和溶液→再加入少量蒸馏水→加入活性炭脱色→加热煮沸→趁热过滤→冷却结晶→抽滤→洗涤→干燥;
(6)上述制备过程的产率是35.29%.(结果保留4位有效数字).
分析 5.0ml苯胺、7.4ml冰醋酸、0.10g锌粒混合加热至沸腾30min,趁热倒入水中析出晶体,抽滤洗涤干燥得到粗产品,重结晶得到较纯净的产品,
(1)加入锌粒的目的是和酸反应生成氢气,在氢气环境中避免苯胺被氧化,韦氏分馏柱作用冷凝回流乙酸和苯胺;
(2)由物质铵的沸点可知,这几种反应物和生成物在105℃的条件下,只能蒸出H2O;
(3)因为在水中,相比而言,乙酰苯胺的溶解度较小,所以可以用来洗去未反应的乙酸和苯胺,同时降低乙酰苯胺的溶解度,促使其析出;
(4)乙酰苯胺在冷水中的溶解度会更小;
(5)避免晶体在过滤过程中有损失,所以要趁热过滤、冷去结晶;
(6)结合化学方程式计算乙酰苯胺的理论产量,进而计算制备过程的产率=$\frac{实际产量}{理论产量}$×100%.
解答 解:(1)苯胺易被氧化,锌和醋酸反应生成氢气提供氢气环境防治苯胺被氧化,韦氏分馏柱作用的是冷凝回流乙酸和苯胺,提高原料的利用率,
故答案为:制备氢气防止苯胺被氧化;冷凝回流乙酸和苯胺,提高原料的利用率;
(2)由物质的沸点可知,这几种反应物和生成物在105℃的条件下,只能蒸出H2O,故锥形瓶中收集到的馏分主要是H2O,故答案为:H2O;
(3)因为在水中,相比而言,乙酰苯胺的溶解度较小,所以可以用来洗去未反应的乙酸和苯胺,同时降低乙酰苯胺的溶解度,促使其析出,
故答案为:洗去未反应的乙酸和苯胺,同时降低乙酰苯胺的溶解度,促使其析出;
(4)乙酰苯胺在冷水中的溶解度会更小,应选择冷水,
故答案为:A;
(5)步骤4重结晶的过程:粗产品溶于沸水中配成饱和溶液→再加入少量蒸馏水→加入活性炭脱色→加热煮沸→趁热过滤→冷却结晶→抽滤→洗涤→干燥,避免晶体过滤过程中有损失,所以要趁热过滤,
故答案为:趁热过滤;冷却结晶;
(5)依据化学方程式: ,可知乙酰苯胺的理论产量为:0.055mol×135g/mol=7.425g因此,上述制备过程的产率是:$\frac{2.62g}{7.425g}$×100%=35.29%,
,可知乙酰苯胺的理论产量为:0.055mol×135g/mol=7.425g因此,上述制备过程的产率是:$\frac{2.62g}{7.425g}$×100%=35.29%,
故答案为:35.29%.
点评 本题考查有机物的合成、有机化学实验,侧重考查学生对数据的分析处理能力,是对学生综合能力的考查,需要学生具备扎实的基础,难度中等.

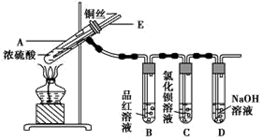
实验步骤:
①先连接如图所示的装置,检查好气密性,再加入试剂;
②加热A试管,待B试管中品红溶液褪色后,熄灭酒精灯;
③将Cu丝向上抽动离开液面.
请回答下列问题:
(1)A试管中发生反应的化学方程式为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
(2)能够证明铜与浓硫酸反应生成气体的实验现象是B试管中品红溶液褪色.
(3)在盛有BaCl2溶液的C试管中,除了导管口有气泡外,无其他明显现象,若将其中的溶液分成两份,分别滴加下列溶液,将产生沉淀的化学式填入表中对应的位置.
| 滴加的溶液 | 氯水 | 氨水 |
| 沉淀的化学式 | BaSO4 | BaSO3 |
反应原理:
相关资料:
| 名称 | 相对分子质量 | 性状 | 熔点/℃ | 溶解度 | |
| 水 | 乙醇 | ||||
| 甲苯 | 92 | 无色液体易烯易挥发 | -95 | 不溶 | 易溶 |
| 苯甲酸 | 122 | 白色片状或针状晶体 | 122.4(100℃升华) | 25℃0.35g 80℃2.7g | 易溶 |
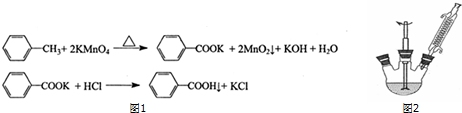
①如图2组装反应装置(冷凝水、夹持及加热装置未画出),并在三颈烧瓶中依次加入120mL水、稍过量高锰酸钾和3.0mL甲苯(密度为0.866g/mL).
②将三颈烧瓶中的混合液体搅拌、加热至沸腾,直到甲苯完全反应.
③趁热过滤反应混合物.若滤液呈紫色,则需加入适量的亚硫酸氢钠溶液至紫色褪去后再过滤,用热水洗涤滤渣,洗涤液合并至滤液中.
④用冰水冷却滤液,然后用浓盐酸酸化,过滤,用少量冷水洗涤滤渣,得到苯甲酸粗产品,经重结晶得到精制的苯甲酸.
回答下列问题:
(1)仪器 a名称为(蛇形)冷凝管.
(2)判断甲苯己完全反应的现象是三颈烧瓶中混合液不再分层、回流液不再出现油珠.
(3)实验步骤④中,用少量冷水而不用热水洗涤滤渣的目的是减少苯甲酸因溶解造成损失;苯甲酸粗产品除了可用重结晶法精制外,还可用升华法.
(4)精制的苯甲酸纯度测定:称取1.220g样品,用稀乙醇溶解并配成100mL溶液,分别取25.00mL溶液,用0.1000mo1•L-1NaOH标准溶液滴定,三次滴定消耗NaOH溶液的体积分别为V1=22.48mL.V2=22.52mL.V3=23.80mL.
①配制溶液时用稀乙醇而不用蒸馏水作溶剂的原因是常温下苯甲酸微溶于水而易溶于乙醇.
②若用酚酞作指示剂,确定滴定终点的现象是滴加最后一滴氢氧化钠标准溶液后,溶液由无色变为浅红色,且30秒不褪色.
③产品的纯度为90%.
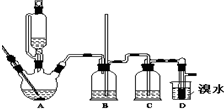 实验室制备1,2二溴乙烷的反应原理如下:
实验室制备1,2二溴乙烷的反应原理如下:①CH3-CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2═CH2↑+H2O
②CH2═CH2+Br2→BrCH2CH2Br(1,2-二溴乙烷)
可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚用少量溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示:有关数据列表如下:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
a.引发反应b.加快反应速度 c.防止乙醇挥发d.减少副产物乙醚生成
(2)在装置C中应加入c,其目的是吸收反应中可能生成的酸性气体;
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)判断该制备反应已经结束的最简单方法是溴的颜色完全褪去.
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后产物应在下层(填“上”、“下”);
(5)若产物中有少量未反应的Br2,最好用b洗涤除去;
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇
(6)若产物中有少量副产物乙醚,可用蒸馏的方法除去;
(7)反应过程中应用冷水冷却装置D,其主要目的是冷却可避免溴的大量挥发;但又不能过度冷却(如用冰水),其原因是产品1,2-二溴乙烷的熔点(凝固点)低,过度冷却会凝固而堵塞导管.
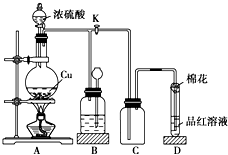 某化学兴趣小组为探究铜跟浓硫酸的反应,用如图所示装置进行有关实验.请回答:
某化学兴趣小组为探究铜跟浓硫酸的反应,用如图所示装置进行有关实验.请回答: