题目内容
20.常温下,下列四种溶液:①0.10mol•L-1 (NH4)2SO4 ②0.10mol•L-1 NH3•H2O
③0.10mol•L-1 CH3COONH4 ④0.10mol•L-1 NH4HSO4
请根据要求填空:
(1)溶液①呈酸性,其原因是(用离子方程式表示):NH4++H2O?NH3•H2O+H+.
(2)若将溶液②稀释10倍,则稀释后的溶液中c(OH-)大于原来的十分之一(填“大于”、“小于”或“等于”).
(3)实验测得溶液③的pH=7,则c(CH3COO-)=c(NH4+)(填“>”、“<”或“=”).
(4)上述四种溶液中,c(NH4+)由大到小的顺序为(填序号)①④③②.
(5)将溶液②④混合,写出反应的离子方程式:NH3•H2O+H+=NH4++H2O.
分析 (1)(NH4)2SO4 是强酸弱碱盐,NH4+水解显酸性;
(2)加水稀释,一水合氨的电离平衡被促进;
(3)溶液的pH=7,则c(OH-)=c(H+),根据电荷守恒来分析;
(4)根据①③④是强电解质,能完全电离,而②为弱电解质,不能完全电离,并结合②中含2个铵根离子、③④中只含一个铵根离子,且③发生双水解、④中铵根离子的水解被抑制来分析;
(5)溶液②④混合,发生的是NH3•H2O和H+的反应,生成NH4+和水.
解答 解:(1)(NH4)2SO4 是强酸弱碱盐,NH4+水解显酸性:NH4++H2O?NH3•H2O+H+,故答案为:NH4++H2O?NH3•H2O+H+;
(2)加水稀释,一水合氨的电离平衡向右移,即电离被促进,电离出更多的氢氧根,故将溶液②稀释10倍,则稀释后的溶液中c(OH-)大于原来的十分之一,故答案为:大于;
(3)根据电荷守恒可知:c(OH-)+c(CH3COO-)=c(H+)+c(NH4+),而溶液的pH=7,即c(OH-)=c(H+),故有:c(CH3COO-)=c(NH4+),故答案为:=;
(4)根据①③④是强电解质,能完全电离,而②为弱电解质,不能完全电离,故②中c(NH4+)最小;
而②中含2个铵根离子、③④中只含一个铵根离子,故②中c(NH4+)最大;
而③中铵根离子发生双水解、④中铵根离子的水解被抑制,故④中的c(NH4+)大于③,故c(NH4+)由大到小的顺序为①④③②,故答案为:①④③②;
(5)溶液②④混合,发生的是NH3•H2O和H+的反应,生成NH4+和水,离子方程式为:NH3•H2O+H+=NH4++H2O,故答案为:NH3•H2O+H+=NH4++H2O.
点评 本题考查了盐类的水解离子方程式的书写和离子浓度的大小比较,难度不大,应注意在比较离子浓度时电荷守恒的运用.

①化学反应原理为:
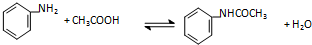
②相关物质的物理常数
| 物质 | 相对分子质量 | 熔点(℃) | 沸点 | 溶解度(g) | |
| 水 | 乙醇 | ||||
| 苯胺 | 93 | -6 | 184 | 3.42(20℃) | 任意比混溶 |
| 乙酸 | 60 | 17 | 117.9 | 任意比混溶 | 任意比混溶 |
| 乙酰苯胺 | 135 | 114 | 304 | 0.56(20℃) 3.45(50℃) 5.20(100℃) | 36.9(20℃) |

已知:Ⅰ苯胺易被氧化;Ⅱ韦氏分馏柱作用与原理类似于冷凝管
请回答以下问题:
(1)加入锌粒的目的是制备氢气防止苯胺被氧化;韦氏分馏柱作用的是冷凝回流乙酸和苯胺,提高原料的利用率;
(2)步骤1中保持柱顶温度约为105℃,则锥形瓶中收集到的馏分主要是H2O;
(3)步骤2中将反应液倒入水中的目的是洗去未反应的乙酸和苯胺,同时降低乙酰苯胺的溶解度,促使其析出;
(4)步骤3中洗涤剂最好选择A;
A.冷水 B.热水 C.15%的乙醇溶液 D.NaOH溶液
(5)步骤4重结晶的过程:粗产品溶于沸水中配成饱和溶液→再加入少量蒸馏水→加入活性炭脱色→加热煮沸→趁热过滤→冷却结晶→抽滤→洗涤→干燥;
(6)上述制备过程的产率是35.29%.(结果保留4位有效数字).
| A. | 在托盘天平的两托盘中分别放等质量的纸,称取2.0g NaOH固体 | |
| B. | 将NaOH固体在烧杯中溶解后迅速小心转移至250mL容量瓶中 | |
| C. | 定容时不小心加水超过了刻度线,此时迅速用胶头滴管吸出一些 | |
| D. | 摇匀后发现凹液面最底点低于刻度线,再补加蒸馏水到凹液面最底点与刻度线相平 |
 如图:A处通入氯气,关闭B阀时,C处干燥红色布条无变化,打开B阀时,C处干燥的红色布条褪色.则下列说法正确的是( )
如图:A处通入氯气,关闭B阀时,C处干燥红色布条无变化,打开B阀时,C处干燥的红色布条褪色.则下列说法正确的是( )| A. | D中可以盛放浓硫酸 | B. | D中可以盛放饱和食盐水 | ||
| C. | D中可以盛放水 | D. | A处通入的是干燥的氯气 |
| A. | 依据分子组成中含有氢原子的数目,将酸分为一元酸、二元酸等 | |
| B. | 依据是否有电子转移,将化学反应分为氧化还原反应和非氧化还原反应 | |
| C. | 依据分散质粒子直径的大小,将分散系分为溶液、胶体、浊液 | |
| D. | 依据组成元素的种类,将纯净物分为单质和化合物 |
| A. | 镁条溶于盐酸是吸热反应 | B. | 中和反应是吸热反应 | ||
| C. | 铝热反应属于吸热反应 | D. | 碳酸钙分解是吸热反应 |
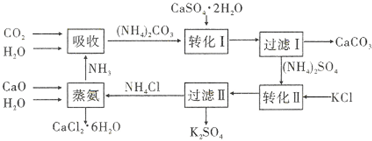
(1)过滤I操作所得固体中,除CaCO3外还含有CaSO4 (填化学式)等物质,该固体可用作生产水泥的原料.
(2)写出石膏悬浊液中加入碳酸铵溶液后发生反应的离子方程式:CaSO4+CO32-=CaCO3+SO42-;
(3)本工艺中所用的原料除CaSO4•2H2O,KCl外,还需要CaCO3(或CaO)、NH3、H2O等原料.
(4)过滤I操作所得滤液是(NH4)2SO4溶液.检验滤液中含有CO32-的方法是用滴管取少量滤液于试管中,滴加盐酸,若产生气泡,证明滤液中含有CO32-;
(5)已知不同温度下K2SO4在100g水中达到饱和时溶解的量如下表:
| 温度(℃) | 0 | 20 | 60 |
| K2SO4溶解的量(g) | 7.4 | 11.1 | 18.2 |
(6)氯化钙结晶水合物(CaCl2•6H2O)是目前常用的无机储热材料,选择的依据是ad (填序号).
a.熔点较低(29℃熔化) b.能导电
c.能制冷 d.无毒.
